bolečina je zelo pomembna funkcija človeškega telesa, vključno z vpletenostjo nociceptorjev in centralnega živčnega sistema ali CNS, za prenos sporočil iz škodljive stimulacije v možgane. Nociceptorji so nadledvične žleze, ki so odgovorne za zaznavanje nevarnih ali škodljivih dražljajev in prenos električnih signalov v živčni sistem. Receptorji so prisotni v koži, notranjih organih, mišicah, sklepih in možganskih ovojnicah, da odkrijejo vrsto stimulacije, ki je lahko mehanska, toplotna ali kemična.
Obstajata dve vrsti nociceptorjev:
- C-vlakna bi bila najpogostejša vrsta in se počasi izvajajo in se odzivajo na dražljaje. Ker proteini v membrani receptorja pretvarjajo stimulacijo v električne impulze, ki se lahko prenašajo skozi živčni sistem.
- Znano je, da vlakna A-delta delujejo hitreje in prenašajo sporočila o ostri, trenutni bolečini.
Poleg tega obstajajo tihi nociceptorji, ki so običajno omejeni na dražljaje, vendar jih je mogoče "prebuditi" z visoko intenzivno mehansko stimulacijo kot odziv na kemične mediatorje iz telesa. Nociceptorji imajo lahko veliko različnih napetostno odvisnih postaj za transdukcijo, ki povzročijo niz akcijskih potencialov, da začnejo električno signalizacijo v živčni sistem. Razdražljivost in obnašanje celice temeljita na vrstah kanalov v nociceptorju.
Pri obravnavanju mehanizma bolečine je pomembno razlikovati med nocicepcijo in bolečino. Nocicepcija je normalen odziv telesa na škodljive dražljaje, vključno z refleksi pod nadpragom, ki ščitijo človeško telo pred poškodbami. Bolečino zaznamo šele, ko je dosežen nadprag, da ti nociceptorji dosežejo možno dejanje in sprožijo pot bolečine, ki je sorazmerno visok. Namen spodnjega članka je prikazati celične in molekularne mehanizme bolečine, vključno z akutno bolečino in kronično bolečino ali vztrajno bolečino, kot je navedeno spodaj.
Kazalo
Celični in molekularni mehanizmi bolečine
Minimalizem
Živčni sistem zazna in razlaga širok spekter toplotnih in mehanskih dražljajev ter okoljskih in endogenih kemičnih dražljajev. Kadar so intenzivni, ti dražljaji povzročajo akutno bolečino, pri vztrajni poškodbi pa tako periferni kot osrednji živčni sistemi na poti prenosa bolečine izkazujejo izjemno plastičnost, povečujejo signale bolečine in povzročajo preobčutljivost. Kadar plastičnost olajša zaščitne reflekse, je lahko koristna, ko pa spremembe vztrajajo, lahko pride do kronične bolečine. Genetske, elektrofiziološke in farmakološke študije pojasnjujejo molekularne mehanizme, ki so podlaga za odkrivanje, kodiranje in modulacijo škodljivih dražljajev, ki povzročajo bolečino.
Uvod: akutna proti trajni bolečini
Sposobnost zaznavanja škodljivih dražljajev je bistvenega pomena za preživetje in dobro počutje organizma. To dramatično ponazarja pregled posameznikov, ki trpijo za prirojenimi nepravilnostmi, zaradi katerih ne morejo zaznati bolečih dražljajev. Ti ljudje ne morejo čutiti prebadajoče bolečine zaradi ostrega predmeta, toplote odprtega ognja ali celo neugodja, povezanega z notranjimi poškodbami, kot je zlomljena kost. Posledično ne izvajajo ustreznega zaščitnega vedenja pred temi pogoji, od katerih so mnogi lahko smrtno nevarni.
Pogosteje spremembe v poti bolečine vodijo v preobčutljivost, tako da bolečina preživi svojo uporabnost kot akutni opozorilni sistem in namesto tega postane kronična in izčrpavajoča. Na določeni ravni je to mogoče razumeti kot podaljšek normalnega procesa celjenja, pri čemer poškodbe tkiva ali živcev povzročijo hiperaktivnost za spodbujanje varovanja poškodovanega območja. Sončne opekline na primer povzročijo začasno preobčutljivost prizadetega območja. Posledično se običajno neškodljivi dražljaji, kot sta lahek dotik ali toplota, zaznajo kot boleči (pojav, imenovan alodinija), ali običajno boleči dražljaji izzovejo bolečino večje intenzivnosti (imenovano hiperalgezija). V skrajnem primeru se preobčutljivost ne odpravi. Dejansko posamezniki, ki trpijo za artritisom, post-herpetično nevralgijo (po napadu skodle) ali kostnim rakom, doživljajo intenzivno in pogosto neprekinjeno bolečino, ki ni le fiziološko in psihično izčrpavajoča, ampak lahko tudi ovira okrevanje. Kronična bolečina lahko traja tudi dolgo po akutni poškodbi, ki se morda najpogosteje pojavi kot bolečina v križu ali išias.
Persistentni ali kronični bolečinski sindromi se lahko sprožijo ali vzdržujejo na perifernih in/ali centralnih lokusih. V obeh primerih je razjasnitev molekul in tipov celic, ki so osnova normalnega (akutnega) občutka bolečine, ključnega pomena za razumevanje mehanizmov, na katerih temelji preobčutljivost za bolečino. V tem pregledu poudarjamo molekularno kompleksnost primarnih aferentnih živčnih vlaken, ki zaznavajo škodljive dražljaje. Ne povzemamo samo obdelave akutne bolečine, ampak tudi opišemo, kako se spremembe v obdelavi bolečine pojavijo pri poškodbi tkiva ali živca.
Globoke razlike med akutno in kronično bolečino poudarjajo dejstvo, da bolečina ne povzroča nespremenljiv, trdo ožičen sistem, temveč je posledica delovanja visokoplastičnih molekul in vezij, katerih molekularna biokemična in nevroanatomska osnova sta v središču pozornosti. trenutne študije. Pomembno je, da so te nove informacije identificirale številne potencialne terapevtske cilje za zdravljenje bolečine. Tu se osredotočamo na periferne nevrone in nevrone drugega reda v hrbtenjači; bralec se napoti na nekaj odličnih pregledov mehanizmov obdelave supraspinalne bolečine, ki vključujejo izjemne vpoglede, ki so jih slikovne študije prinesle na področje (Apkarian et al., 2005).
Anatomski pregled
Nocicepcija je proces, s katerim intenzivne toplotne, mehanske ali kemične dražljaje zazna subpopulacija perifernih živčnih vlaken, imenovana nociceptorji (Basbaum in Jessell, 2000). Celična telesa nociceptorjev se nahajajo v ganglijih hrbtnih korenin (DRG) za telo in trigeminalnem gangliju za obraz in imajo tako periferno kot osrednjo aksonsko vejo, ki inervira njihov ciljni organ oziroma hrbtenjačo. Nociceptorji so vznemirjeni šele, ko intenzivnosti dražljaja dosežejo škodljiv razpon, kar kaže, da imajo biofizične in molekularne lastnosti, ki jim omogočajo selektivno zaznavanje in odzivanje na potencialno škodljive dražljaje. Obstajata dva glavna razreda nociceptorjev. Prvi vključuje mielinizirane (A?) aference srednjega premera, ki posredujejo akutno, dobro lokalizirano »prvo« ali hitro bolečino. Ti mielinizirani aferenti se bistveno razlikujejo od večjega premera in hitro prevodnega A? vlakna, ki se odzivajo na neškodljivo mehansko stimulacijo (tj. lahek dotik). Drugi razred nociceptorjev vključuje nemielinizirana "C" vlakna majhnega premera, ki prenašajo slabo lokalizirano, "drugo" ali počasno bolečino.
Elektrofiziološke študije so nadalje razdelile A? nociceptorje v dva glavna razreda. Tip I (HTM: mehanski nociceptorji z visokim pragom) se odzivajo tako na mehanske kot na kemične dražljaje, vendar imajo relativno visoke toplotne pragove (>50C). Če pa se toplotni dražljaj ohrani, se bodo ti aferenti odzvali pri nižjih temperaturah. In kar je najpomembneje, senzibilizirajo (tj. toplotni ali mehanski prag se bo znižal) ob poškodbi tkiva. Tip II A? nociceptorji imajo precej nižji toplotni prag, vendar zelo visok mehanski prag. Dejavnost tega aferenta skoraj zagotovo posreduje »prvi« odziv akutne bolečine na škodljivo vročino. Dejansko kompresijski blok mieliniziranih perifernih živčnih vlaken odpravlja prvo, ne pa drugo bolečino. Nasprotno pa vlakna tipa I verjetno posredujejo pri prvi bolečini, ki jo povzročijo vbod igle in drugi intenzivni mehanski dražljaji.
Nemielinizirana vlakna C so tudi heterogena. Tako kot mielinizirani aferenti je večina vlaken C polimodalnih, to pomeni, da vključujejo populacijo, ki je tako toplotno kot mehansko občutljiva (CMH) (Perl, 2007). Posebej zanimivi so toplotno odzivni, vendar mehansko neobčutljivi nemielinizirani aferenti (tako imenovani tihi nociceptorji), ki razvijejo mehansko občutljivost šele ob poškodbi (Schmidt et al., 1995). Ti aferenti so bolj odzivni na kemične dražljaje (kapsaicin ali histamin) v primerjavi s CMH in verjetno pridejo v poštev, ko kemično okolje vnetja spremeni njihove lastnosti. Podskupine teh aferentov se tudi odzivajo na različne pruritogene, ki povzročajo srbenje. Omeniti velja, da niso vsa vlakna C nociceptorji. Nekateri se odzivajo na hlajenje, posebno zanimiva populacija nemieliniziranih aferentov pa se odzove na neškodljivo božanje dlakave kože, ne pa na toplotno ali kemično stimulacijo. Zdi se, da ta slednja vlakna posredujejo prijeten dotik (Olausson et al., 2008).
Nevroanatomska in molekularna karakterizacija nociceptorjev je nadalje pokazala njihovo heterogenost, zlasti za vlakna C (Snider in McMahon, 1998). Tako imenovana 'peptidergična' populacija nociceptorjev C sprošča nevropeptide, snov P in peptid, povezan z genom kalcitonin (CGRP); izražajo tudi nevrotrofinski receptor TrkA, ki se odziva na živčni rastni faktor (NGF). Nepeptidergična populacija C nociceptorjev izraža receptor za nevrotrofin c-Ret, ki je tarča nevrotrofičnega faktorja, ki izvira iz glial (GDNF), pa tudi neurturin in artemin. Velik odstotek c-Ret-pozitivne populacije veže tudi izolektin IB4 in izraža receptorje, ki so vezani na G protein iz družine Mrg (Dong et al., 2001), kot tudi specifične podtipe purinergičnih receptorjev, zlasti P2X3. Nociceptorje lahko ločimo tudi glede na njihovo diferencialno ekspresijo kanalov, ki dajejo občutljivost na toploto (TRPV1), mraz (TRPM8), kislo okolje (ASIC) in množico kemičnih dražilnih snovi (TRPA1) (Julius in Basbaum, 2001). Kot je navedeno spodaj, se ti funkcionalno in molekularno heterogeni razredi nociceptorjev povezujejo s specifično funkcijo pri odkrivanju različnih načinov bolečine.
Nociceptor: dvosmerni signalni stroj
Na splošno velja, da nociceptor nosi informacije v eni smeri in prenaša škodljive dražljaje od periferije do hrbtenjače. Vendar imajo primarna aferentna vlakna edinstveno morfologijo, imenovano psevdo-unipolarna, pri kateri tako osrednji kot periferni terminali izhajajo iz skupnega aksonskega peclja. Večina beljakovin, ki jih sintetizira DRG ali trigeminalna ganglijska celica, je porazdeljena tako na centralni kot na periferni terminal. To razlikuje primarni aferentni nevron od prototipičnega nevrona, kjer je prejemna veja nevrona (dendrit) biokemično ločena od veje prenosa (aksona). Biokemična enakovrednost osrednjega in perifernega terminala pomeni, da lahko nociceptor pošilja in sprejema sporočila z obeh koncev. Na primer, tako kot je osrednji terminal lokus sproščanja nevrotransmiterjev, odvisnega od Ca2+, tako periferni terminal sprošča različne molekule, ki vplivajo na lokalno tkivno okolje. Nevrogeno vnetje se pravzaprav nanaša na proces, pri katerem periferno sproščanje nevropeptidov, CGRP in snovi P, povzroči vazodilatacijo oziroma ekstravazacijo plazemskih beljakovin (Basbaum in Jessell, 2000). Poleg tega se bo samo periferni terminal nociceptorja odzval na okoljske dražljaje (boleča toplota, mraz in mehanska stimulacija), tako periferni kot osrednji terminal lahko cilja množica endogenih molekul (kot so pH, lipidi in nevrotransmiterji). ki uravnavajo njegovo občutljivost. Iz tega sledi, da je mogoče razviti terapevtike, usmerjene na oba terminala, da bi vplivali na prenos bolečinskih sporočil. Na primer, spinalna (intratekalna) dostava morfija cilja na opioidne receptorje, izražene z osrednjim terminalom nociceptorjev, medtem ko lokalno uporabljena zdravila (kot so lokalni anestetiki ali kapsaicin) uravnavajo bolečino z delovanjem na perifernem terminalu.
Centralne projekcije nociceptorja
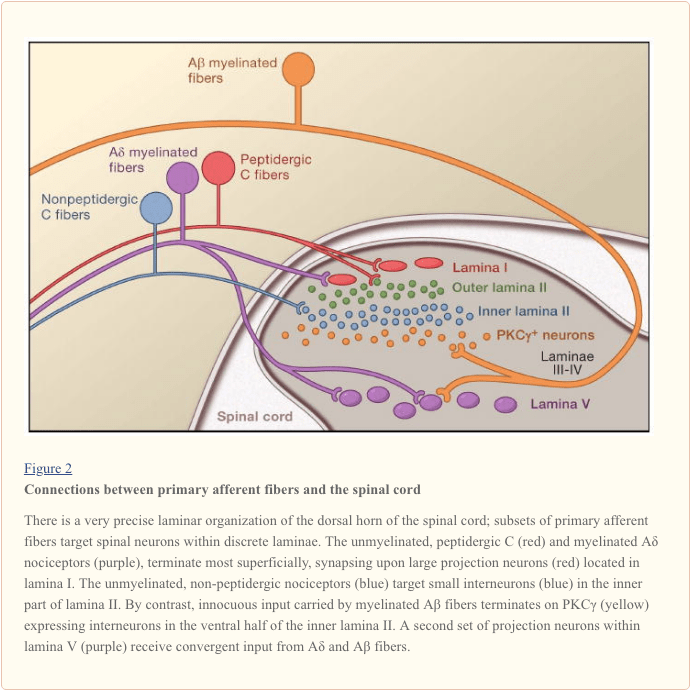
Primarna aferentna živčna vlakna segajo v dorzalni rog hrbtenjače, ki je organiziran v anatomsko in elektrofiziološko ločene lamine (Basbaum in Jessell, 2000) (slika 1). Na primer, A? nociceptorji projicirajo tako na lamino I kot tudi na globlji hrbtni rog (lamina V). Nizek prag, hitro voden A? aferenti, ki se odzivajo na lahek dotik, projicirajo v globoke lamine (III, IV in V). Nasprotno pa C nociceptorji projicirajo bolj površno na lamine I in II.
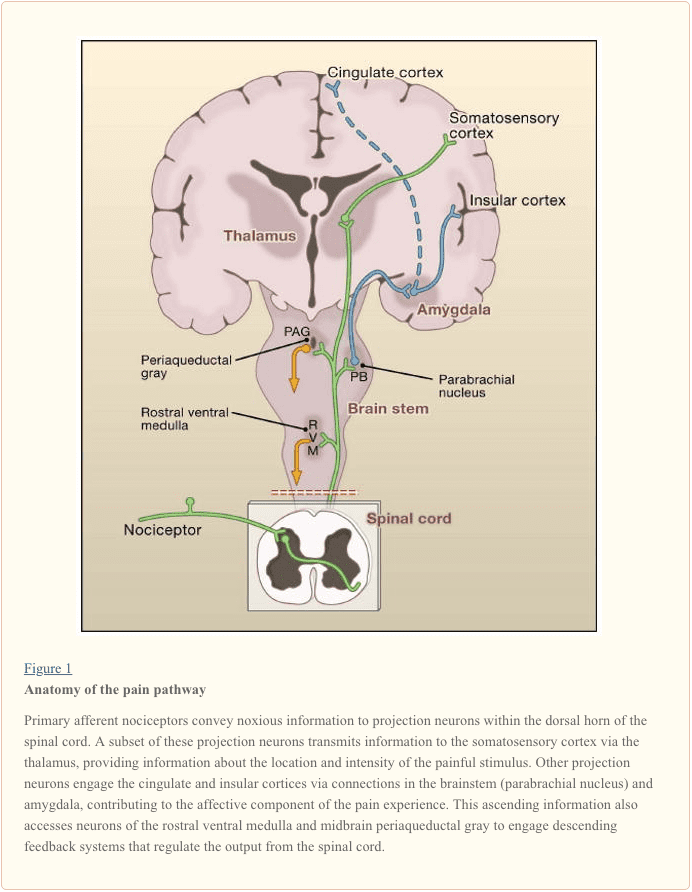
Ta izjemna razslojenost aferentnih podtipov znotraj površnega hrbtnega roga je dodatno poudarjena z različnimi vzorci projekcije C nociceptorjev (Snider in McMahon, 1998). Na primer, večina peptidergičnih vlaken C se konča znotraj lamine I in najbolj dorzalnega dela lamine II. Nasprotno pa se nepeptidergični aferenti, vključno s podskupino, ki izraža Mrg, končajo v sredini lamine II. Za najbolj ventralni del lamine II je značilna prisotnost ekscitatornih internevronov, ki izražajo gama izoformo protein kinaze C (PKC), ki je bila vpletena v trajno bolečino, ki jo povzroča poškodba (Malmberg et al., 1997). Nedavne študije kažejo, da je ta PKC? plast je tarča pretežno mieliniziranih nenociceptivnih aferentov (Neumann et al., 2008). V skladu s temi anatomskimi študijami elektrofiziološke analize kažejo, da se nevroni hrbtenjače znotraj lamine I na splošno odzivajo na škodljivo stimulacijo (preko vlaken A? in C), nevroni v laminah III in IV se odzivajo predvsem na neškodljivo stimulacijo (preko A?) in nevroni v lamini V prejmejo konvergenten neškodljiv in škodljiv vhod prek neposrednega (monosinaptične) A? in A? vhodi in posredni (polisinaptični) vhodi C vlaken. Slednji se imenujejo nevroni širokega dinamičnega razpona (WDR), saj se odzivajo na širok razpon intenzivnosti dražljajev. Običajno obstaja tudi visceralni vnos v te nevrone WDR, tako da posledična konvergenca somatskega in visceralnega verjetno prispeva k pojavu navedene bolečine, pri čemer je bolečina, ki je posledica poškodbe, ki prizadene visceralno tkivo (na primer srce pri angini), se nanaša na somatsko strukturo (na primer ramo).
Ascendentne poti in supraspinalna obdelava bolečine
Projekcijski nevroni v laminah I in V predstavljajo glavni izhod iz hrbtnega roga v možgane (Basbaum in Jessell, 2000). Ti nevroni so izvor več naraščajočih poti, vključno s spinotalamičnim in spinoretikulotalamičnim traktom, ki prenašajo sporočila o bolečini v talamus oziroma možgansko deblo (slika 2). Prvi je še posebej pomemben za senzorično-diskriminativne vidike doživljanja bolečine (to je, kje je dražljaj in kako intenziven je?), medtem ko je slednji morda bolj pomemben za slabo lokalizirane bolečine. V zadnjem času se je pozornost osredotočila na projekcije hrbtenjače v parabrahialni predel dorzolateralnega mosta, ker izhod tega področja zagotavlja zelo hitro povezavo z amigdalo, regijo, za katero se na splošno šteje, da obdeluje informacije, pomembne za averzivne lastnosti bolečine. izkušnje.
Iz teh lokusov možganskega debla in talamusa informacije dosežejo kortikalne strukture. Za bolečino ni enega samega možganskega področja (Apkarian et al., 2005). Bolečina je namesto tega posledica aktivacije porazdeljene skupine struktur, od katerih so nekatere bolj povezane s senzorično-diskriminativnimi lastnostmi (kot je somatosenzorična skorja), druge pa s čustvenimi vidiki (kot sta sprednji cingularni girus in otočna skorja). V zadnjem času so slikovne študije pokazale aktivacijo prefrontalnih kortikalnih območij, pa tudi regij, ki na splošno niso povezane z obdelavo bolečine (kot so bazalni gangliji in mali možgani). Ali in v kolikšni meri je aktivacija teh regij bolj povezana z odzivom posameznika na dražljaj ali z zaznavanjem bolečine, ni jasno. Končno slika 2 ponazarja močne padajoče kontrole, ki vplivajo (tako pozitivno kot negativno) na prenos bolečinskih sporočil na ravni hrbtenjače.
Akutna bolečina
Primarno aferentno živčno vlakno zazna okoljske dražljaje (toplotne, mehanske ali kemične narave) in te informacije prevede v jezik živčnega sistema, in sicer električni tok. Najprej pregledamo napredek pri razumevanju molekularne osnove zaznavanja signalov in temu sledimo s kratkim pregledom nedavnih genetskih študij, ki poudarjajo prispevek napetostno odvisnih kanalov k prenosu bolečine (slika 3).
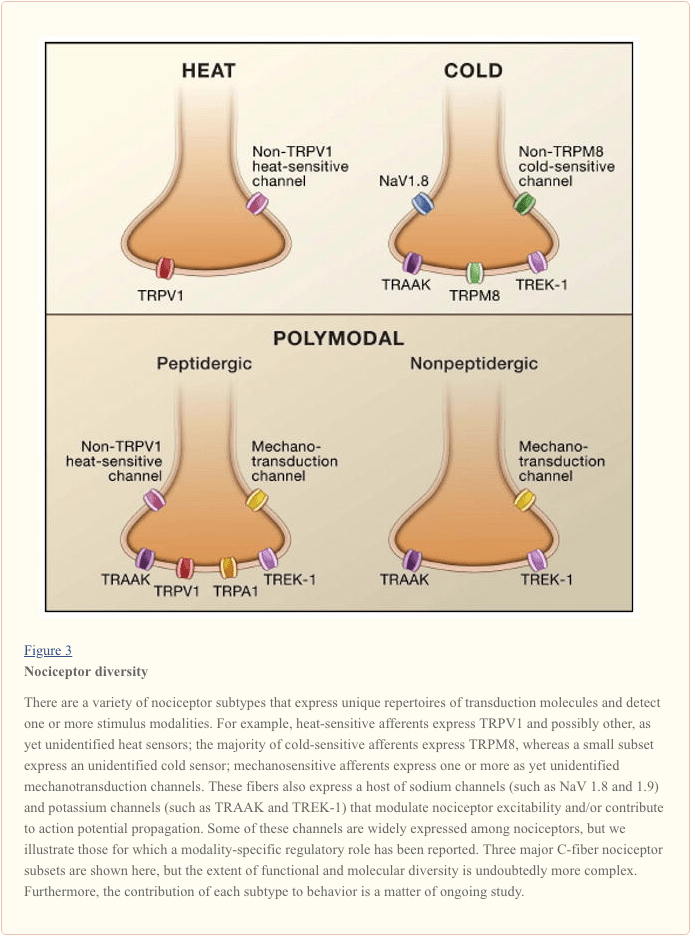
Aktiviranje nociceptorja: vročina
Človeške psihofizične študije so pokazale, da obstaja jasna in ponovljiva razmejitev med zaznavanjem neškodljive toplote in škodljive toplote, kar nam omogoča, da prepoznamo in se izognemo temperaturam, ki lahko povzročijo poškodbe tkiva. Ta prag bolečine, ki se običajno giblje okoli 43 °C, je vzporeden s toplotno občutljivostjo C in tipa II A? nociceptorji, opisani prej. Dejansko kultivirani nevroni iz disociiranih ganglijev hrbtnih korenin kažejo podobno občutljivost na toploto. Večina kaže prag 43°C, manjša kohorta pa se aktivira zaradi močnejše vročine (prag >50°C) (Cesare in McNaughton, 1996; Kirschstein et al., 1997; Leffler et al., 2007; Nagy in Rang , 1999). Molekularni vpogledi v proces toplotnega občutenja so izhajali iz kloniranja in funkcionalne karakterizacije receptorja za kapsaicin, glavno pekočo sestavino v "pekočih" čili paprikah. Kapsaicin in sorodne vaniloidne spojine povzročajo pekočo bolečino z depolarizacijo specifičnih podskupin C in A? nociceptorji z aktivacijo receptorja kapsaicina (ali vaniloidnega) TRPV1, enega od približno 30 članov družine ionskih kanalov z večjim prehodnim potencialom receptorjev (TRP) (Caterina et al., 1997). Klonirani kanal TRPV1 je tudi zaprt s povišanjem temperature okolice, s pragom toplotne aktivacije (?43°C).
Številni dokazi podpirajo hipotezo, da je TRPV1 endogeni pretvornik škodljive toplote. Prvič, TRPV1 je izražen v večini toplotno občutljivih nociceptorjev (Caterina et al., 1997). Drugič, tokovi, ki jih povzroča kapsaicin in toplota, so podobni, če ne identični, glede na svoje farmakološke in biofizikalne lastnosti, tako kot pri heterologno izraženih kanalih TRPV1. Tretjič, in kot je podrobneje opisano spodaj, odzive, ki jih povzroča TRPV1, izrazito povečajo pro-algetična ali pro-vnetna sredstva (kot so zunajcelični protoni, nevrotrofini ali bradikinin), ki vsi povzročijo preobčutljivost na toploto in vivo (Tominaga et al. al., 1998)). Četrtič, analiza miši brez tega ionskega kanala ni razkrila le popolne izgube občutljivosti na kapsaicin, ampak te živali kažejo tudi znatno poslabšanje njihove sposobnosti zaznavanja in odzivanja na škodljivo toploto (Caterina et al., 2000; Davis et al., 2000). ). Te študije so pokazale tudi bistveno vlogo tega kanala v procesu, pri katerem poškodba in vnetje tkiva vodita do toplotne preobčutljivosti, kar odraža sposobnost TRPV1, da služi kot molekularni integrator toplotnih in kemičnih dražljajev (Caterina et al., 2000; Davis et al. ., 2000).
Prispevek TRPV1 k akutnemu občutku toplote pa so izpodbijali podatki, zbrani iz pripravka ex vivo, v katerem so posnetki pridobljeni iz some nevronov DRG z nedotaknjenimi osrednjimi in perifernimi vlakni. V eni študiji niso opazili razlik v toplotno izzvanih odzivih divjih živali in živali s pomanjkanjem TRPV1 (Woodbury et al., 2004), vendar je novejša analiza te skupine pokazala, da miši s pomanjkanjem TRPV1 dejansko nimajo kohorta nevronov, ki jih močno aktivira škodljiva toplota (Lawson et al., 2008). Skupaj z zgoraj opisanimi rezultati sklepamo, da TRPV1 nedvomno prispeva k akutnemu občutku toplote, vendar se strinjamo, da TRPV1 ni edini odgovoren za prenos toplote.
V zvezi s tem, medtem ko miši s pomanjkanjem TRPV1 manjka komponenta vedenjske toplotne občutljivosti, uporaba visokega odmerka kapsaicina za ablacijo osrednjih terminalov primarnih aferentnih vlaken, ki izražajo TRPV1, povzroči bolj globoko, če ne celo popolno izgubo občutljivosti na akutno toplotno bolečino. (Cavanaugh et al., 2009). Kar zadeva mutant TRPV1, obstaja tudi izguba toplotne hiperalgezije, ki jo povzroči poškodba tkiva. Ti rezultati skupaj kažejo, da je tako TRPV1-odvisna kot tudi TRPV1-neodvisna komponenta škodljive toplotne občutljivosti posredovana preko nociceptorjev, ki izražajo TRPV1.
Kaj je odgovorno za TRPV1 neodvisno komponento toplotnega občutka? Številni drugi podtipi kanalov TRPV, vključno s TRPV2, 3 in 4, so se pojavili kot kandidati za toplotne pretvornike, ki bi lahko pokrili zaznavanje intenzivnosti dražljajev, ki spremljajo intenzivnost TRPV1, vključno z zelo vročimi (> 50 °C) in toplimi (sredina 30). °Cs) temperature (Lumpkin in Caterina, 2007). Heterološko izraženi kanali TRPV2 prikazujejo temperaturni aktivacijski prag ?52°C, medtem ko se TRPV3 in TRPV4 aktivirata med 25 – 35°C. TRPV2 je izražen v subpopulaciji A? nevroni, ki se odzivajo na visokopragovno škodljivo toploto in njegove biofizikalne lastnosti so podobni tistim pri naravnih visokopražnih toplotnih tokovih (Leffler et al., 2007; Rau et al., 2007). Zaenkrat še ni objavljenih poročil, ki bi opisovala bodisi fiziološke bodisi vedenjske teste TRPV2 knockout miši. Po drugi strani pa miši s pomanjkanjem TRPV3 in TRPV4 pokažejo spremenjeno toplotno prednost, ko so postavljene na površino razvrščenih temperatur, kar kaže, da ti kanali na nek način prispevajo k zaznavanju temperature in vivo (Guler et al., 2002). Zanimivo je, da tako TRPV3 kot TRPV4 kažeta bistveno večjo ekspresijo v keratinocitih in epitelijskih celicah v primerjavi s senzoričnimi nevroni, kar povečuje možnost, da odkrivanje neškodljivih toplotnih dražljajev vključuje funkcionalno interakcijo med kožo in osnovnimi primarnimi aferentnimi vlakni (Chung et al., 2003; Peier et al., 2002b).
Aktiviranje nociceptorja: prehlad
Kar zadeva kapsaicin in TRPV1, so bila naravna hladilna sredstva, kot sta mentol in evkaliptol, uporabljena kot farmakološke sonde za identifikacijo in karakterizacijo mraz občutljivih vlaken in celic (Hensel in Zotterman, 1951; Reid in Flonta, 2001) ter molekule, ki so pod njihovo vedenje. Dejansko se večina nevronov, občutljivih na mraz, odzove na mentol in pokaže prag toplotne aktivacije ?25°C. TRPM8 je kanal, občutljiv na mraz in mentol, katerega fiziološke značilnosti se ujemajo s tistimi pri naravnih hladnih tokovih, miši s pomanjkanjem TRPM8 pa kažejo zelo znatno izgubo mentola in odzivov, ki jih povzroča mraz, na ravni celičnih ali živčnih vlaken. Prav tako te živali kažejo hude pomanjkljivosti v vedenjskih odzivih, ki jih povzroča mraz (Bautista et al., 2007; Colburn et al., 2007; Dhaka et al., 2007) v širokem razponu temperatur, ki segajo od 30 do 10 °C. Tako kot v primeru TRPV1 in he at, miši s pomanjkanjem TRPM8 niso popolnoma neobčutljive na mraz. Na primer, ostaja majhna (?4%) kohorta nevronov, občutljivih na mraz, mentol neobčutljivih, ki imajo nizek prag aktivacije, približno 12 °C. To je lahko posledica preostale občutljivosti na mraz, ki jo opazimo pri vedenjskih testih, pri čemer se živali s pomanjkanjem TRPM8 še vedno lahko izognejo izjemno hladnim površinam pod 10 °C. Pomembno je, da miši s pomanjkanjem TRPM8 kažejo normalno občutljivost na škodljivo toploto. Dejansko sta TRPV1 in TRPM8 izražena v nevronskih populacijah, ki se večinoma ne prekrivajo, v skladu s pojmom, da so mehanizmi za odkrivanje vročega in hladnega organizirani v anatomsko in funkcionalno ločene "označene črte".
Na podlagi heterolognih ekspresijskih sistemov je bilo predlagano tudi, da TRPA1 zazna mraz, zlasti v območju škodljivih (<15 °C). Poleg tega TRPA1 aktivirata hladilni spojini icilin in mentol (Bandell et al., 2004; Karashima et al., 2007; Story et al., 2003), čeprav v relativno visokih koncentracijah v primerjavi z njihovimi učinki na TRPM8. Vendar pa še vedno obstajajo nesoglasja glede tega, ali je naravni ali rekombinantni TRPA1 intrinzično občutljiv na mraz (Bandell et al., 2004; Jordt et al., 2004; Karashima et al., 2009; Nagata et al., 2005; Zurborg et al. ., 2007). Ta polemika ni bila razrešena z analizo dveh neodvisnih mišjih linij s pomanjkanjem TRPA1. Na celični ravni je ena študija pokazala normalne odzive, ki jih povzroča mraz, v nevronih s pomanjkanjem TRPA1 po 30-sekundnem padcu temperature z 22 °C na 4 °C (Bautista et al., 2006); novejša študija je pokazala zmanjšanje nevronov, občutljivih na mraz, s 26 % (WT) na 10 % (TRPA1-/-), ko so testirali po 200-sekundnem padcu temperature, s 30 °C na 10 °C (Karashima et al. ., 2009). V vedenjskih študijah miši s pomanjkanjem TRPA1 kažejo odzive, podobne divjem tipu steljcev v testih hlajenja s hladno ploščo in acetonom (Bautista et al., 2006). Druga študija, ki je uporabljala iste teste, je pokazala, da so samice, ne pa samci, izločene živali TRPA1 pokazale oslabljeno občutljivost na mraz v primerjavi z divjimi sorodniki (Kwan et al., 2006). Karashima in sod. niso ugotovili razlike v drgetanju ali latencah odvzema tace pri samcih ali samicah miši s pomanjkanjem TRPA1 na testu hladne plošče, vendar so opazili, da je dolgotrajna izpostavljenost hladni površini povzročila skakanje pri divjih živalih, vendar ne pri živalih s pomanjkanjem TRPA1 (Karashima et al. sod., 2009). Verjetno slednji fenotip odraža prispevek TRPA1 k občutljivosti na mraz pri poškodbi tkiva, ne pa k akutni bolečini zaradi mraza. V skladu s slednjo hipotezo posnetki posameznih živčnih vlaken ne kažejo zmanjšanja akutne občutljivosti na mraz pri miših s pomanjkanjem TRPA1 (Cavanaugh et al., 2009; Kwan et al., 2009). Nazadnje je treba omeniti, da miši, zdravljene s kapsaicinom, ki nimajo osrednjih koncev vlaken, ki izražajo TRPV1, kažejo nedotaknjene vedenjske odzive na hladne in škodljive hladne dražljaje (Cavanaugh et al., 2009). Ker je TRPA1 izražen v podskupini TRPV1-pozitivnih nevronov, sledi, da TRPA1 ni potreben za normalno akutno občutljivost na mraz. Prihodnje študije z uporabo miši s pomanjkanjem tako za TRPM8 kot TRPA1 bodo pomagale rešiti te težave in identificirati molekule in tipe celic, ki so osnova za preostalo TRPM8 neodvisno komponento občutljivosti na mraz.
Dodatne molekule, vključno z napetostno odvisnimi natrijevimi kanali (obravnavani spodaj), napetostno odvisnimi kalijevimi kanali in kalijevimi kanali KCNK v ozadju z dvema porama, se usklajujejo s TRPM8 za natančno nastavitev hladnih pragov ali za širjenje akcijskih potencialov, ki jih povzroča mraz (Viana et al. , 2002; Zimmermann et al., 2007; Noel et al., 2009). Na primer, specifični zaviralci Kv1 povečajo temperaturni prag nevronov, občutljivih na mraz, in injekcija teh inhibitorjev v zadnjo šapo glodavcev zmanjša vedenjske odzive na mraz, ne pa na toploto ali mehanske dražljaje (Madrid et al., 2009). Dva člana družine kanalov KCNK, KCNK2 (TREK-1) in KCNK4 (TRAAK), sta izražena v podskupini nociceptorjev C-vlaken (Noel et al., 2009) in ju je mogoče modulirati s številnimi fiziološkimi in farmakološkimi dražljaji, vključno s pritiskom in temperaturo. Poleg tega miši brez teh kanalov kažejo nenormalnosti v občutljivosti na pritisk, toploto in mraz (Noel et al., 2009). Čeprav te ugotovitve kažejo, da kanala TREK-1 in TRAAK modulirata razdražljivost nociceptorjev, ostaja nejasno, kako je njihova notranja občutljivost na fizične dražljaje povezana z njihovim prispevkom in vivo k toplotni ali mehanski transdukciji.
Aktiviranje nociceptorja: mehansko
Somatosenzorični sistem zazna kvantitativno in kvalitativno raznolike mehanske dražljaje, od lahkega krtačenja kože do raztezanja stene mehurja. Različni mehanoobčutljivi nevronski podtipi so specializirani za odkrivanje te raznolike palete mehanskih dražljajev in jih je mogoče razvrstiti glede na prag občutljivosti. Mehanoreceptorji z visokim pragom vključujejo vlakna C in počasi prilagajanje A? mehanoreceptorska (AM) vlakna, ki se končata kot prosti živčni končiči v koži. Mehanoreceptorji z nizkim pragom vključujejo A? D-lasna vlakna, ki se končajo na dlakah v koži in zaznajo rahel dotik. Končno, A? vlakna, ki inervirajo Merklove celice, Pacinove celice in lasne mešičke, zaznajo teksturo, vibracije in lahki pritisk.
Tako kot v primeru toplotnih dražljajev je bila mehanska občutljivost raziskana na več ravneh, vključno z disociiranimi senzoričnimi nevroni v kulturi, posnetki vlaken ex-vivo, kot tudi posnetki iz osrednjih (tj. nevronov hrbtnega roga) in meritvami vedenjskega učinka. Ex-vivo posnetki kožnih živcev so bili najbolj informativni pri usklajevanju lastnosti dražljajev (kot so intenzivnost, frekvenca, hitrost in prilagoditev) specifičnim podvrstam vlaken. Na primer, A? vlakna so povezana predvsem z občutljivostjo na lahek dotik, medtem ko so C in A? vlakna so predvsem odzivna na škodljive mehanske poškodbe. Na vedenjski ravni se mehanska občutljivost običajno oceni z dvema tehnikama. Najpogostejši vključuje merjenje refleksnih odzivov na konstantno silo, ki jo kalibrirani filamenti (Von Freyeve dlake) uporabljajo na zadnjo šapo glodavca. Drugi izvaja vse večji pritisk na taco ali rep preko sistema sponk. V obeh primerih se informacije o mehanskih pragih pridobijo v normalnih (akutnih) situacijah ali pri poškodbah (preobčutljivost). Eden od izzivov na tem področju je bil razviti dodatne vedenjske teste, ki merijo različne vidike mehanosenziranja, kot sta diskriminacija teksture in vibracije, kar bo olajšalo preučevanje tako škodljivega kot neškodljivega dotika (Wetzel et al., 2007).
Na celični ravni je mogoče pritisk na celična telesa kultiviranih somatosenzoričnih nevronov (ali na njihove nevrite) s stekleno sondo, spremembo osmotske moči ali raztezanjem z raztezanjem elastične površine kulture, čeprav ni jasno, kateri dražljaj je najboljši. posnema fiziološki pritisk (Bhattacharya et al., 2008; Cho et al., 2006; Cho et al., 2002; Drew et al., 2002; Hu in Lewin, 2006; Lin et al., 2009; Takahashi in Gotoh, 2000 ). Odzive je mogoče oceniti z elektrofiziološkimi metodami ali metodami slikanja živih celic. Soglasje takih študij je, da ta pritisk odpre mehansko občutljiv kationski kanal, da izzove hitro depolarizacijo. Vendar pa je pomanjkanje specifičnih farmakoloških sond in molekularnih markerjev, s katerimi bi lahko označili te odzive ali označili ustrezne nevronske podtipe, oviralo poskuse uskladitve celičnih aktivnosti z anatomsko ali funkcionalno opredeljenimi podrazredi živčnih vlaken. Te omejitve so ovirale tudi molekularno analizo mehanosenziranja in identifikacijo molekul, ki sestavljajo mehanotransdukcijski stroj. Kljub temu so se pojavili številni kandidati, ki večinoma temeljijo na študijah mehanosenziranja v modelnih genetskih organizmih. Ortologi teh proteinov pri sesalcih so bili pregledani z uporabo pristopov ciljanja genov pri miših, pri katerih se lahko zgoraj omenjene tehnike uporabijo za oceno pomanjkljivosti v mehanosenziranju na vseh ravneh. Spodaj na kratko povzemamo nekaj kandidatov, razkritih v teh študijah.
Kandidati za mehanotransduktorje: kanali DEG/ENaC
Študije ogorčice Caenorhabditis elegans (C. elegans) so identificirale mec-4 in mec-10, člana družine degenerinskih/epitelnih Na+ kanalov (DEG/ENaC), kot mehanotransduktorja v nevronih dotika telesa (Chalfie, 2009). Na podlagi teh študij so bili ortologi sesalcev ASIC 1, 2 in 3 predlagani kot kanali za mehanotransdukcijo. ASIC so kislinsko občutljivi ionski kanali, ki služijo kot receptorji za zunajcelične protone (tkivna acidoza), ki nastanejo med ishemijo (glej spodaj). Čeprav so ti kanali izraženi tako z nizko kot z visokim pragom mehanoobčutljivih nevronov, genetske študije ne podpirajo enotno bistvene vloge pri mehanotransdukciji. Miši brez funkcionalnih kanalov ASIC1 kažejo normalne vedenjske odzive na kožni dotik in malo ali nič sprememb v mehanski občutljivosti, če jih ocenimo s snemanjem z enim vlaknom (Page et al., 2004; Price et al., 2000). Podobno periferna živčna vlakna miši s pomanjkanjem ASIC2 kažejo le rahlo zmanjšanje sprožitve akcijskega potenciala na mehanske dražljaje, medtem ko vlakna s pomanjkanjem ASIC3 kažejo rahlo povečanje (pri teh živalih niso opazili nobene spremembe mehanskih pragov ali osnovne vedenjske mehanske občutljivosti) ( Price in sod., 2001; Roza in sod., 2004). Analiza miši s pomanjkanjem tako za ASIC2 kot za ASIC3 prav tako ne podpira vloge teh kanalov pri kožni mehanotransdukciji (Drew et al., 2004). Čeprav se zdi, da ti kanali igrajo vlogo pri mišično-skeletni in ishemični bolečini (glej spodaj), njihov prispevek k mehanosenziranju ostaja nerešen.
Genetske študije kažejo, da kanali C. elegans mec-4/mec-10 obstajajo v kompleksu s stomatinu podobnim proteinom MEC-2 (Chalfie, 2009). Miši brez ortologa MEC-2, SLP3, kažejo izgubo mehanosenzitivnosti pri nizkem pragu A? in A? vlaken, ne pa v C vlaknih (Wetzel et al., 2007). Te miši kažejo spremenjeno otipno ostrino, vendar kažejo normalne odzive na škodljiv pritisk, kar kaže, da SLP3 prispeva k odkrivanju neškodljivih, vendar ne škodljivih mehanskih dražljajev. Ali SLP3 deluje v mehanotransdukcijskem kompleksu ali je v interakciji z ASIC v senzoričnih nevronih sesalcev, ni znano.
Kandidati za mehanotransduktorje: TRP kanali
Kot je navedeno zgoraj, se TRPV2, kadar je izražen heterologno, ne odziva le na škodljivo toploto, ampak tudi na osmotsko raztezanje. Poleg tega se naravni kanali TRPV2 v žilnih gladkih mišičnih celicah aktivirajo z neposrednim sesanjem in osmotskimi dražljaji (Muraki et al., 2003). Vloga TRPV2 za somatosenzorično mehanotransdukcijo in vivo še ni bila preizkušena.
TRPV2 je robustno izražen v srednjem in velikem premeru, A? vlakna, ki se odzivajo tako na mehanske kot na toplotne dražljaje (Caterina et al., 1999; Muraki et al., 2003). TRPV4 kaže skromno ekspresijo v senzoričnih ganglijih, vendar je bolj obilno izražen v ledvicah in na raztezanje občutljivih urotelijskih celic mehurja (Gevaert et al., 2007; Mochizuki et al., 2009). Pri heterologni ekspresiji se je pokazalo, da se tako TRPV2 kot TRPV4 odzivata na spremembe osmotskega tlaka (Guler et al., 2002; Liedtke et al., 2000; Mochizuki et al., 2009; Strotmann et al., 2000). Analiza živali s pomanjkanjem TRPV4 kaže na vlogo pri osmosenzaciji, saj živali z izločanjem kažejo okvare krvnega tlaka, vodnega ravnovesja in praznjenja mehurja (Gevaert et al., 2007; Liedtke in Friedman, 2003). Te živali kažejo normalno akutno kožno mehanosenziranje, vendar kažejo pomanjkljivosti v modelih mehanske in termične hiperalgezije (Alessandri-Haber et al., 2006; Chen et al., 2007; Grant et al., 2007; Suzuki et al., 2003). Tako TRPV4 verjetno ne bo služil kot primarni mehanotransduktor v senzoričnih nevronih, lahko pa prispeva k preobčutljivosti na bolečino, ki jo povzroča poškodba.
Predlagano je tudi, da TRPA1 služi kot detektor mehanskih dražljajev. Heterološko izraženi TRPA1 pri sesalcih aktivirajo membranski krenatorji (Hill in Schaefer, 2007) in ortolog črvov je občutljiv na mehanski pritisk, ki se uporablja s sesalno pipeto (Kindt et al., 2007). Vendar pa miši s pomanjkanjem TRPA1 kažejo le šibke napake v mehanosenzoričnem vedenju in rezultati so nedosledni. Dve študiji nista poročali o spremembi mehanskih pragov pri živalih s pomanjkanjem TRPA1 (Bautista et al., 2006; Petrus et al., 2007), medtem ko je tretja študija poročala o primanjkljajih (Kwan et al., 2006). Novejša študija kaže, da sta C in A? mehanoobčutljiva vlakna pri živalih, ki izločajo TRPA1, imajo spremenjene odzive na mehansko stimulacijo (nekatera se povečajo, druga zmanjšajo) (Kwan et al., 2009). Ali in kako se ti različni fiziološki učinki kažejo na ravni vedenja, ni jasno. Zdi se, da TRPA1 skupaj ne deluje kot primarni detektor akutnih mehanskih dražljajev, ampak morda modulira razdražljivost mehanosenzitivnih aferentov.
Kandidati za mehanotransduktorje: kanali KCNK
Poleg potencialne vloge mehanotransduktorja KCNK2 in 4 (glej zgoraj), se je o KCNK18 razpravljalo o njegovem možnem prispevku k mehanosenziranju. Tako je KCNK18 tarča hidroksi-a-sanshoola, ostre sestavine sečuanskega popra, ki povzroča mravljinčenje in otrplost, kar kaže na interakcijo z nevroni, občutljivimi na dotik (Bautista et al., 2008; Bryant in Mezine, 1999; Sugai et al. sod., 2005). KCNK18 se izraža v podskupini domnevnih peptidergičnih C vlaken in nizkopražnih (A?) mehanoreceptorjev, kjer služi kot glavni regulator trajanja in razdražljivosti akcijskega potenciala (Bautista et al., 2008; Dobler et al., 2007). Poleg tega sanshool depolarizira osmo- in mehanoobčutljive senzorične nevrone velikega premera, pa tudi podskupino nociceptorjev (Bautista et al., 2008; Bhattacharya et al., 2008). Čeprav ni znano, ali je KCNK18 neposredno občutljiv na mehansko stimulacijo, je lahko kritičen regulator razdražljivosti nevronov, vključenih v neškodljiv ali škodljiv občutek dotika.
Če povzamemo, molekularna osnova mehanotransdukcije pri sesalcih še zdaleč ni razjasnjena. Mehanska preobčutljivost kot odziv na poškodbo tkiva ali živca predstavlja velik klinični problem, zato ostaja razjasnitev biološke osnove dotika v normalnih in patofizioloških pogojih eden glavnih izzivov somatosenzoričnih in bolečinskih raziskav.
Aktiviranje nociceptorja: kemično
Kemonocicepcija je proces, s katerim primarni aferentni nevroni zaznajo okoljske dražilne dejavnike in endogene dejavnike, ki jih povzroča fiziološki stres. V kontekstu akutne bolečine kemonociceptivni mehanizmi sprožijo averzivne odzive na različna okoljska dražila. Tudi tu imajo kanali TRP vidno vlogo, kar morda ni presenetljivo glede na to, da delujejo kot receptorji za dražilne snovi rastlinskega izvora, vključno s kapsaicinom (TRPV1), mentolom (TRPM8), kot tudi ostrimi sestavinami v rastlinah gorčice in česna, izotiocianati in tiosulfinati (TRPA1) (Bandell et al., 2004; Caterina et al., 1997; Jordt et al., 2004; McKemy et al., 2002; Peier et al., 2002a).
V zvezi z okoljskimi dražilnimi snovmi se je TRPA1 izkazal kot posebno zanimiv član te skupine. To je zato, ker se TRPA1 odziva na spojine, ki so strukturno raznolike, vendar enotne v svoji sposobnosti tvorbe kovalentnih aduktov s tiolnimi skupinami. Na primer, alil izotiocianat (iz wasabija) ali alicin (iz česna) sta membransko prepustna elektrofila, ki aktivirata TRPA1 s kovalentno modificiranjem cisteinskih ostankov znotraj amino-terminalne citoplazemske domene kanala (Hinman et al., 2006, Macpherson et al., 2007; 1). Kako to spodbuja povezovanje kanalov, trenutno ni znano. Kljub temu je preprosto ugotavljanje pomena reaktivnosti tiola v tem procesu vključevalo TRPA2 kot ključno fiziološko tarčo za široko in kemično raznoliko skupino strupenih snovi iz okolja. Pomemben primer je akrolein (2006-propenal), zelo reaktiven ?,?-nenasičen aldehid, prisoten v solzivcu, izpušnih plinih vozil ali dimu gorečega rastlinja (tj. gozdnih požarov in cigaret). Akrolein in druga hlapna dražilna sredstva (kot so hipoklorit, vodikov peroksid, formalin in izocianati) aktivirajo senzorične nevrone, ki inervirajo oči in dihalne poti, kar povzroča bolečino in vnetje (Bautista et al., 2008; Bessac in Jordt, 2009; Caceres et al. , 1). To dejanje ima lahko še posebej hude posledice za tiste, ki trpijo za astmo, kroničnim kašljem ali drugimi pljučnimi motnjami. Miši brez TRPA2009 kažejo močno zmanjšano občutljivost na taka sredstva, kar poudarja kritično naravo tega kanala kot senzoričnega detektorja reaktivnih okoljskih dražilnih snovi (Caceres et al., 1). Poleg teh okoljskih toksinov je TRPA2006 tarča nekaterih splošnih anestetikov (kot je izofluoran) ali presnovnih stranskih produktov kemoterapevtskih učinkovin (kot je ciklofosfamid), kar je verjetno osnova za nekatere škodljive stranske učinke teh zdravil, vključno z akutno bolečino in močnim nevro vnetjem. (Bautista et al., 2008; Matta et al., XNUMX).
Končno, kemična dražila in druga pro-algetična sredstva nastajajo tudi endogeno kot odziv na poškodbe tkiva ali fiziološki stres, vključno z oksidativnim stresom. Takšni dejavniki lahko delujejo samostojno ali v kombinaciji, da senzibilizirajo nociceptorje na toplotne in/ali mehanske dražljaje in s tem znižajo prag bolečine. Rezultat tega delovanja je izboljšanje zaščitnih in zaščitnih refleksov po poškodbi. Tako kemonocicepcija predstavlja pomemben vmesnik med akutno in vztrajno bolečino, zlasti v kontekstu poškodbe in vnetja perifernega tkiva, kot je podrobneje obravnavano spodaj.
Akutna bolečina: vodenje signala bolečine
Ko primarni aferentni terminal prevede toplotne in mehanske signale, receptorski potencial aktivira različne napetostno odvisne ionske kanale. Napetostno odvisni natrijevi in kalijevi kanali so ključnega pomena za ustvarjanje akcijskih potencialov, ki prenašajo signale nociceptorjev v sinapse v hrbtnem rogu. Napetostno odvisni kalcijevi kanali igrajo ključno vlogo pri sproščanju nevrotransmiterjev iz centralnih ali perifernih nociceptorskih terminalov, da povzročijo bolečino oziroma nevrogeno vnetje. Našo razpravo omejimo na člane družin natrijevih in kalcijevih kanalčkov, ki služijo kot tarče trenutno uporabljenih analgetikov ali pri katerih človeška genetika podpira vlogo pri prenosu bolečine. Nedavni pregled je razpravljal o pomembnem prispevku kalijevih kanalov KCNQ, vključno s terapevtsko koristjo povečanja aktivnosti kanalov K+ za zdravljenje trdovratne bolečine (Brown in Passmore, 2009).
Napetostno omejeni natrijevi kanali
V somatosenzoričnih nevronih so izraženi različni natrijevi kanali, vključno s kanali, občutljivimi na tetrodotoksin (TTX), Nav1.1, 1.6 in 1.7 ter kanali, ki niso občutljivi na TTX, Nav1.8 in 1.9. V zadnjih letih je prispevek Nav1.7 deležen veliko pozornosti, saj spremenjena aktivnost tega kanala vodi do različnih motenj bolečine pri človeku (Cox et al., 2006; Dib-Hajj et al., 2008). Bolniki z mutacijami izgube funkcije znotraj tega gena ne morejo zaznati škodljivih dražljajev in so zaradi pomanjkanja zaščitnih refleksov poškodovani. Nasprotno pa številne mutacije pridobivanja funkcije v Nav1.7 vodijo v hiperekscitabilnost kanala in so povezane z dvema različnima motnjama bolečine pri ljudeh, eritromelalgijo in paroksizmalno ekstremno bolečinsko motnjo, ki obe povzročata intenzivne pekoče občutke (Estacion et al., 2008; Fertleman et al., 2006; Yang et al., 2004). Študije na živalih so pokazale, da se Nav1.7 močno poveča pri različnih modelih vnetne bolečine. Dejansko analiza miši brez Nav1.7 v C nociceptorjih podpira ključno vlogo tega kanala pri mehanski in toplotni preobčutljivosti po vnetju ter pri akutnih odzivih na škodljive mehanske dražljaje (Nassar et al., 2004). Nekoliko presenetljivo je, da je bolečina, ki jo povzroči poškodba živca, nespremenjena, kar kaže, da različni podtipi natrijevih kanalov ali druga populacija aferentov, ki izražajo Nav1.7, prispevajo k nevropatski bolečini (Nassar et al., 2005).
Natrijev kanal Nav1.8 je prav tako močno izražen pri večini C nociceptorjev. Tako kot pri živalih z izločanjem Nav1.7 tudi tiste, ki nimajo Nav1.8, kažejo skromne pomanjkljivosti v občutljivosti na neškodljivo ali škodljivo toploto ali neškodljiv pritisk; vendar pa kažejo oslabljene odzive na škodljive mehanske dražljaje (Akopian et al., 1999). Nav1.8 je potreben tudi za prenos hladnih dražljajev, saj so miši brez tega kanala neobčutljive na mraz v širokem razponu temperatur (Zimmermann et al., 2007). To je zato, ker je Nav1.8 edinstven med napetostno občutljivimi natrijevimi kanali, saj se pri nizki temperaturi ne inaktivira, zaradi česar je prevladujoči generator akcijskega potenciala v hladnih pogojih.
Zanimivo je, da transgenske miši, ki nimajo podskupine senzoričnih nevronov, ki izraža Nav1.8, ki so bile izbrisane s ciljno ekspresijo davičnega toksina A (Abrahamsen et al., 2008), kažejo oslabljene odzive tako na mehanske dražljaje z nizkim in visokim pragom kot na mraz. Poleg tega je mehanska in toplotna preobčutljivost pri modelih vnetne bolečine močno oslabljena. Diferencialni fenotipi miši brez kanalov Nav1.8 v primerjavi z delecijo nevronov, ki izražajo Nav1.8, verjetno odražajo prispevek več podtipov napetostno odvisnih natrijevih kanalov k prenosu sporočil bolečine.
Napetostno odvisni natrijevi kanali so tarče lokalnih anestetikov, kar poudarja potencial za razvoj podtip specifičnih analgetikov. Nav1.7 je še posebej zanimiva tarča za zdravljenje sindromov vnetne bolečine, deloma zato, ker človeške genetske študije kažejo, da bi zaviralci Nav1.7 morali zmanjšati bolečino, ne da bi pri tem spremenili druge bistvene fiziološke procese (glej zgoraj). Druga možna uporaba zaviralcev natrijevih kanalčkov je lahko zdravljenje skrajne preobčutljivosti na mraz, ki je še posebej moteč stranski učinek kemoterapevtikov na osnovi platine, kot je oksaliplatin (Attal et al., 2009). Antagonisti Nav1.8 (ali TRPM8) lahko ublažijo to ali druge oblike hladne alodinije. Končno, velika uporabnost antidepresivov zaviralcev ponovnega privzema serotonina in noradrenalina za zdravljenje nevropatske bolečine je lahko v resnici posledica njihove sposobnosti blokiranja napetostno odvisnih natrijevih kanalov (Dick et al., 2007).
Napetostno omejeni kalcijevi kanali
V nociceptorjih so izraženi različni napetostno odvisni kalcijevi kanalčki. Največ pozornosti so prejeli kalcijevi kanalčki tipa N, P/Q in T. Kanali tipa P/Q so izraženi na sinaptičnih terminalih v laminah II-IV hrbtnega roga. Njihova natančna vloga pri nocicepciji ni popolnoma razrešena. Vendar pa so mutacije v teh kanalih povezane z družinsko hemiplegično migreno (de Vries et al., 2009). Kalcijevi kanali tipa N in T so izraženi tudi s C-vlakni in so povečani v patofizioloških stanjih, kot pri modelih diabetične nevropatije ali po drugih oblikah poškodbe živcev. Živali brez Cav2.2 ali 3.2 kažejo zmanjšano občutljivost na mehanske ali toplotne dražljaje po vnetju ali poškodbi živca (Cao, 2006; Swayne in Bourinet, 2008; Zamponi et al., 2009; Messinger et al., 2009). Poleg tega se ?-konotoksin GVIA, ki blokira kanale tipa N, daje intratekalno (kot zikonotid), da zagotovi lajšanje neozdravljive bolečine pri raku (Rauck et al., 2009).
Vsi kalcijevi kanali so heteromerni proteini, sestavljeni iz ?1 podenot, ki tvorijo pore, in modulacijskih podenot ?2?, ?2? ali ?2?. ?2? podenota uravnava gostoto toka in kinetiko aktivacije in inaktivacije. V C nociceptorjih je ?2? podenota se po poškodbi živca dramatično poveča in igra ključno vlogo pri preobčutljivosti in alodiniji, ki jo povzročajo poškodbe (Luo et al., 2001). Dejansko je ta podenota tarča gabapentinoidnega razreda antikonvulzivov, ki se zdaj pogosto uporabljajo za zdravljenje nevropatske bolečine (Davies et al., 2007).
Trajna bolečina: periferni mehanizmi
Vztrajna bolečina, povezana s poškodbo ali boleznimi (kot so sladkorna bolezen, artritis ali rast tumorja), je lahko posledica sprememb v lastnostih perifernih živcev. To se lahko pojavi kot posledica poškodbe živčnih vlaken, kar vodi do povečanega spontanega sprožitve ali sprememb v njihovih prevodnih ali nevrotransmiterskih lastnostih. Pravzaprav uporabnost lokalnih in celo sistemskih lokalnih anestetikov za zdravljenje različnih nevropatskih bolečinskih stanj (kot je postherpetična nevralgija) verjetno odraža njihovo delovanje na natrijeve kanale, ki se kopičijo v poškodovanih živčnih vlaknih.
Kemična sredina vnetja
Periferna senzibilizacija je pogosteje posledica z vnetjem povezanih sprememb v kemičnem okolju živčnega vlakna (McMahon et al., 2008). Tako poškodbo tkiva pogosto spremlja kopičenje endogenih dejavnikov, ki se sproščajo iz aktiviranih nociceptorjev ali ne-nevralnih celic, ki se nahajajo v poškodovanem območju ali se infiltrirajo v poškodovano območje (vključno z mastociti, bazofili, trombociti, makrofagi, nevtrofilci, endotelnimi celicami, keratinociti in fibroblasti). Skupaj. ti dejavniki, imenovani "vnetna juha", predstavljajo široko paleto signalnih molekul, vključno z nevrotransmiterji, peptidi (snov P, CGRP, bradikinin), eikozinoidi in sorodnimi lipidi (prostaglandini, tromboksani, levkotrieni, endokanabininoidi), , kemokini, pa tudi zunajcelične proteaze in protoni. Zanimivo je, da nociceptorji izražajo enega ali več receptorjev celične površine, ki so sposobni prepoznati in se odzvati na vsako od teh pro-vnetnih ali pro-algetičnih sredstev (slika 4). Takšne interakcije povečajo razdražljivost živčnega vlakna in s tem povečajo njegovo občutljivost na temperaturo ali dotik.
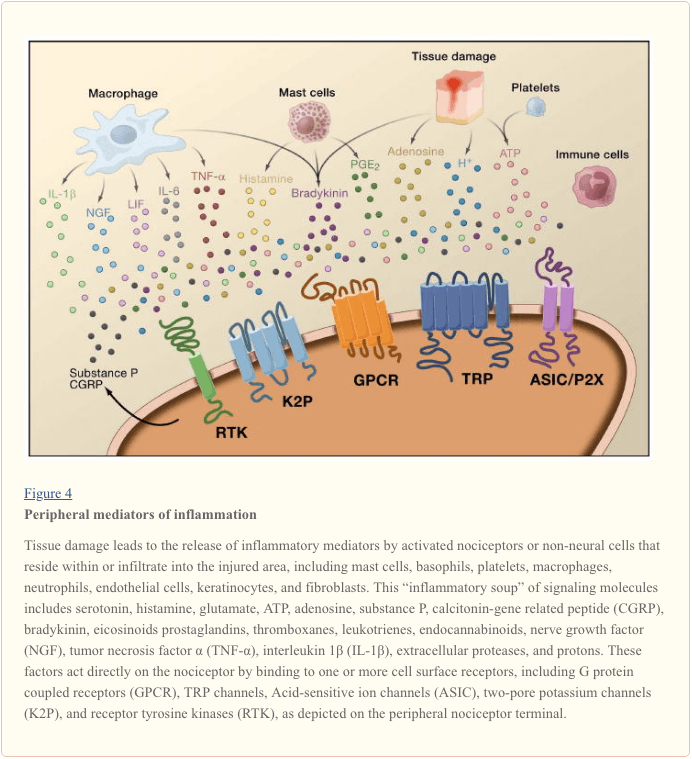
Nedvomno najpogostejši pristop k zmanjševanju vnetne bolečine vključuje zaviranje sinteze ali kopičenja sestavin vnetne juhe. To najbolje ponazarjajo nesteroidna protivnetna zdravila, kot sta aspirin ali ibuprofen, ki zmanjšujejo vnetno bolečino in hiperalgezijo z zaviranjem ciklooksigenaz (Cox-1 in Cox-2), ki sodelujejo pri sintezi prostaglandinov. Drugi pristop je blokiranje delovanja vnetnih sredstev na nociceptorju. Tukaj izpostavljamo primere, ki zagotavljajo nov vpogled v celične mehanizme periferne senzibilizacije ali ki predstavljajo osnovo novih terapevtskih strategij za zdravljenje vnetne bolečine.
NGF je morda najbolj znan po svoji vlogi nevrotrofičnega faktorja, ki je potreben za preživetje in razvoj senzoričnih nevronov med embriogenezo, toda pri odraslih se NGF proizvaja tudi pri poškodbah tkiva in je pomemben sestavni del vnetne juhe (Ritner et al. sod., 2009). Med svojimi številnimi celičnimi tarčami NGF deluje neposredno na nociceptorje peptidergičnih vlaken C, ki izražajo visoko afinitetno receptorsko tirozin kinazo NGF, TrkA, kot tudi receptor za nevrotrofin z nizko afiniteto, p75 (Chao, 2003; Snider in McMahon, 1998). NGF povzroča globoko preobčutljivost na toploto in mehanske dražljaje prek dveh časovno ločenih mehanizmov. Sprva interakcija NGF-TrkA aktivira signalne poti navzdol, vključno s fosfolipazo C (PLC), protein kinazo, aktivirano z mitogenom (MAPK), in fosfoinozitid 3-kinazo (PI3K). To ima za posledico funkcionalno potenciranje ciljnih proteinov na terminalu perifernega nociceptorja, predvsem TRPV1, kar vodi do hitre spremembe celične in vedenjske toplotne občutljivosti (Chuang et al., 2001). Poleg teh hitrih učinkov se NGF retrogradno prenaša tudi v jedro nociceptorja, kjer spodbuja povečano izražanje pronociceptivnih beljakovin, vključno s snovjo P, TRPV1 in napetostno odvisno podenoto natrijevega kanala Nav1.8 (Chao, 2003; Ji idr., 2002). Te spremembe v izražanju genov skupaj povečajo razdražljivost nociceptorja in povečajo nevrogeni vnetni odziv.
Poleg nevrotrofinov poškodba spodbuja sproščanje številnih citokinov, med katerimi je glavni interlevkin 1? (IL-1?) in IL-6 ter faktor tumorske nekroze ? (TNF-?) (Ritner et al., 2009). Čeprav obstajajo dokazi, ki podpirajo neposredno delovanje teh citokinov na nociceptorje, je njihov primarni prispevek k preobčutljivosti na bolečino posledica potenciranja vnetnega odziva in povečane proizvodnje pro-algetikov (kot so prostaglandini, NGF, bradikinin in zunajcelični protoni).
Ne glede na njihove pronociceptivne mehanizme je poseganje v signalizacijo nevrotrofinov ali citokinov postalo glavna strategija za nadzor vnetne bolezni ali posledične bolečine. Glavni pristop vključuje blokiranje NGF ali TNF-? delovanje z nevtralizirajočim protitelesom. V primeru TNF-? je bilo to izjemno učinkovito pri zdravljenju številnih avtoimunskih bolezni, vključno z revmatoidnim artritisom, kar je povzročilo dramatično zmanjšanje tako uničenja tkiva kot spremljajoče hiperalgezije (Atzeni et al., 2005). Ker se glavno delovanje NGF na nociceptor pri odraslih pojavlja v okolju vnetja, je prednost tega pristopa, da se bo hiperalgezija zmanjšala, ne da bi vplivala na normalno zaznavanje bolečine. Dejansko so protitelesa proti NGF trenutno v kliničnih preskušanjih za zdravljenje sindromov vnetne bolečine (Hefti et al., 2006).
Cilji vnetne juhe
TRPV1. Močna preobčutljivost na toploto se lahko razvije pri vnetju ali po injiciranju specifičnih sestavin vnetne juhe (kot sta bradikinin ali NGF). Pomanjkanje takšne senzibilizacije pri miših s pomanjkanjem TRPV1 zagotavlja genetsko podporo ideji, da je TRPV1 ključna sestavina mehanizma, s katerim vnetje povzroči toplotno hiperalgezijo (Caterina et al., 2000; Davis et al., 2000). Študije in vitro so namreč pokazale, da TRPV1 deluje kot polimodalni integrator signala, katerega toplotno občutljivost lahko močno modulirajo komponente vnetne juhe (Tominaga et al., 1998). Nekateri od teh vnetnih dejavnikov (na primer zunajcelični protoni in lipidi) delujejo kot neposredni pozitivni alosterični modulatorji kanala, medtem ko se drugi (bradikinin, ATP in NGF) vežejo na lastne receptorje na primarnih aferentih in modulirajo TRPV1 z aktivacijo nižjega znotrajceličnega kanala. signalne poti. V obeh primerih te interakcije povzročijo globoko znižanje praga toplotne aktivacije kanala, pa tudi povečanje obsega odzivov pri temperaturah nad pragom - biofizičnim ekvivalentom alodinije oziroma hiperalgezije.
Vendar pa ostajajo spori glede znotrajceličnih signalnih mehanizmov, ki so najbolj odgovorni za modulacijo TRPV1 (Lumpkin in Caterina, 2007). Številni TRP kanali pri sesalcih, ki spominjajo na TRP kanale prednikov v očesu muhe, se aktivirajo ali pozitivno modulirajo s fosfolipazo C-posredovano cepljenjem fosfatidil inozitol 4,5 bisfosfata plazemske membrane (PIP2). Seveda obstaja veliko nižjih posledic tega delovanja, vključno z zmanjšanjem membranskega PIP2, zvišanjem ravni diacilglicerola in njegovih presnovkov, povečanim citoplazmatskim kalcijem in posledično aktivacijo protein kinaz. V primeru TRPV1 je bila večina, če ne vse, teh poti vpletenih v proces senzibilizacije in še ni treba videti, katere so najbolj pomembne za vedenjsko toplotno preobčutljivost. Kljub temu obstaja široko soglasje, da je modulacija TRPV1 pomembna za preobčutljivost za bolečino, ki jo povzroča poškodba tkiva, zlasti v okolju vnetja. To bi vključevalo stanja, kot so sončne opekline, okužbe, revmatoidni ali osteoartritis in vnetna bolezen sklede. Drug zanimiv primer je bolečina zaradi kostnega raka (Honore et al., 2009), kjer rast tumorja in uničenje kosti spremljata izjemno robustna tkivna acidoza ter proizvodnja citokinov, nevrotrofinov in prostaglandinov.
TRPA1. Kot je opisano zgoraj, TRPA1 aktivirajo spojine, ki tvorijo kovalentne adukte z ostanki cisteina. Poleg okoljskih toksinov to vključuje endogene tiolne reaktivne elektrofile, ki nastanejo med poškodbo in vnetjem tkiva ali kot posledica oksidativnega ali nitrativnega stresa. Glavna med takšnimi sredstvi sta 4-hidroksi-2-nonenal in 15-deoksi-?12,14-prostaglandin J2, ki sta oba ?,? nenasičeni aldehidi, ki nastanejo s peroksidacijo ali spontano dehidracijo lipidnih sekundarnih prenašalcev (Andersson et al., 2008; Cruz-Orengo et al., 2008; Materazzi et al., 2008; Trevisani et al., 2007). Drugi endogeni agonisti TRPA1 vključujejo nitroolno kislino, vodikov peroksid in vodikov sulfid. Poleg teh neposredno delujočih sredstev TRPA1 posredno modulirajo tudi pro-algetična sredstva, kot je bradikinin, ki delujejo preko receptorjev, povezanih s PLC. Dejansko miši s pomanjkanjem TRPA1 kažejo dramatično zmanjšane celične in vedenjske odzive na vsa ta sredstva, pa tudi zmanjšanje toplotne in mehanske preobčutljivosti, ki jo povzročajo poškodbe tkiva (Bautista et al., 2006; Kwan et al., 2006). Nazadnje, ker ima TRPA1 ključno vlogo pri nevrogenih in drugih vnetnih odzivih tako na endogene povzročitelje kot na hlapne okoljske toksine, je njegov prispevek k vnetju dihalnih poti, kot se pojavlja pri astmi, še posebej zanimiv. Dejansko genetska ali farmakološka blokada TRPA1 zmanjša vnetje dihalnih poti pri modelu astme, ki jo povzroča alergena (Caceres et al., 2009).
ASIC. Kot je navedeno zgoraj, so kanali ASIC člani družine DEG/ENaC, ki se aktivirajo z zakisanjem, in tako predstavljajo še eno pomembno mesto za delovanje zunajceličnih protonov, ki nastanejo kot posledica poškodbe tkiva ali presnovnega stresa. Podtipi ASIC lahko tvorijo različne homomerne ali heteromerne kanale, od katerih ima vsak različno pH občutljivost in profil ekspresije. Kanali, ki vsebujejo podtip ASIC3, so specifično izraženi z nociceptorji in so še posebej dobro predstavljeni v vlaknih, ki inervirajo skeletno in srčno mišico. V teh tkivih anaerobna presnova vodi do kopičenja mlečne kisline in protonov, ki aktivirajo nociceptorje za nastanek mišično-skeletne ali srčne bolečine (Immke in McCleskey, 2001). Zanimivo je, da se kanali, ki vsebujejo ASIC3, odprejo kot odziv na skromno znižanje pH (npr. 7.4 do 7.0), ki se pojavi pri srčni ishemiji (Yagi et al., 2006). Mlečna kislina tudi znatno potencira protonsko sproženo pretvorbo prek mehanizma, ki vključuje kelacijo kalcija (Immke in McCleskey, 2003). Tako kanali, ki vsebujejo ASIC3, zaznajo in integrirajo signale, ki so posebej povezani z mišično ishemijo, in se na ta način funkcionalno razlikujejo od drugih senzorjev kisline na primarnem aferentu, kot je TRPV1 ali drugi podtipi kanalov ASIC.
Trajna bolečina: osrednji mehanizmi
Centralna senzibilizacija se nanaša na proces, s katerim se v centralnem živčnem sistemu vzpostavi stanje hiperekscitabilnosti, ki vodi do okrepljene obdelave nociceptivnih (bolečinskih) sporočil (Woolf, 1983). Čeprav so bili v centralno preobčutljivost vpleteni številni mehanizmi, se tukaj osredotočamo na tri: spremembo glutamatergične nevrotransmisije/preobčutljivosti, posredovane z NMDA receptorjem, izgubo nadzora toničnega zaviranja (dezinhibicija) in interakcije glial-nevronov (slika 5).
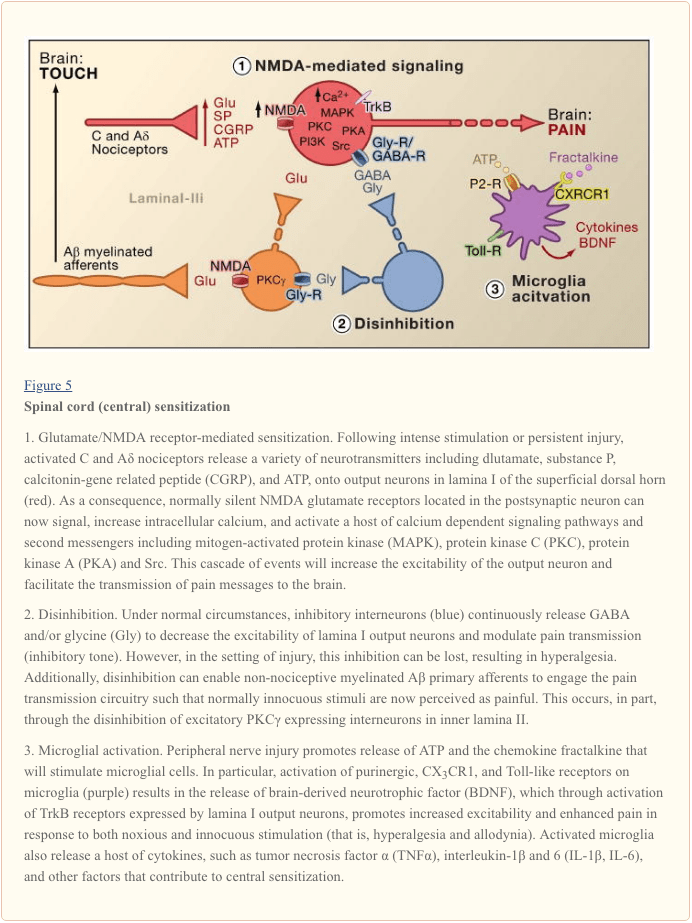
Preobčutljivost, ki jo posreduje glutamat/NMDA receptor
Akutna bolečina je signalizirana s sproščanjem glutamata iz osrednjih terminalov nociceptorjev, ki ustvarja ekscitatorne post-sinaptične tokove (EPSC) v nevronih hrbtnega roga drugega reda. To se zgodi predvsem z aktivacijo postsinaptičnih AMPA in kainatnih podtipov ionotropnih glutamatnih receptorjev. Seštevanje podpragovnih EPSC v postsinaptičnem nevronu bo sčasoma povzročilo sprožitev akcijskega potenciala in prenos sporočila bolečine na nevrone višjega reda. V teh pogojih je podtip glutamatnega kanala NMDA tih, toda v primeru poškodbe bo povečano sproščanje nevrotransmiterjev iz nociceptorjev dovolj depolariziralo postsinaptične nevrone, da bo aktiviralo mirne receptorje NMDA. Posledično povečanje dotoka kalcija lahko okrepi sinaptične povezave med nociceptorji in nevroni prenosa bolečine v dorzalnih rogovih, kar bo posledično poslabšalo odzive na škodljive dražljaje (torej povzročilo hiperalgezijo).
V mnogih pogledih je ta proces primerljiv s tistim, ki je vpleten v plastične spremembe, povezane z dolgotrajno potenciranjem hipokampusa (LTP) (za pregled LTP na poti bolečine glej Drdla in Sandkuhler, 2008). Dejansko zdravila, ki blokirajo LTP hrbtenice, zmanjšajo hiperalgezijo, ki jo povzroča poškodba tkiva. Tako kot v primeru hipokampalne LTP je centralna senzibilizacija hrbtenjače odvisna od zvišanja citosolnega Ca2+ v postsinaptičnem nevronu, ki ga posreduje NMDA. Sočasna aktivacija metabotropnega glutamata in receptorjev za snov P na postsinaptičnem nevronu lahko prispeva tudi k senzibilizaciji s povečanjem citosolnega kalcija. Nadaljnja aktivacija množice signalnih poti in sistemov sekundarnih sporočil, zlasti kinaz (kot so MAPK, PKA, PKC, PI3K, Src), dodatno poveča razdražljivost teh nevronov, deloma z modulacijo funkcije receptorja NMDA (Latremoliere in Woolf, 2009) . Ilustrativen tega modela je dokaz, da spinalne injekcije peptidnega fragmenta devetih aminokislin Src ne samo da moti interakcijo NMDA receptor-Src, ampak tudi izrazito zmanjša preobčutljivost, ki jo povzroča periferna poškodba, ne da bi spremenili akutne bolečine. Src null mutantne miši kažejo tudi zmanjšano mehansko alodinijo po poškodbi živca (Liu et al., 2008).
Poleg povečanja vnosov z mesta poškodbe (primarna hiperalgezija) centralna preobčutljivost prispeva k stanju, v katerem lahko neškodljiva stimulacija območij, ki obkrožajo mesto poškodbe, povzroči bolečino. Ta sekundarna hiperalgezija vključuje heterosinaptično olajšanje, pri čemer vhodi iz A? aferenti, ki se običajno odzivajo na lahek dotik, zdaj vključijo vezje prenosa bolečine, kar povzroči globoko mehansko alodinijo. Dejstvo, da kompresijski blok perifernih živčnih vlaken hkrati prekine prevodnost v A? aferentne in odpravlja sekundarno hiperalgezijo kaže, da so ti nenormalni krogi vzpostavljeni v kliničnih okoljih, pa tudi na živalskih modelih (Campbell et al., 1988).
Izguba GABAergičnih in glicinergičnih kontrol: dezinhibicija
GABAergični ali glicinergični zaviralni internevroni so gosto porazdeljeni v površinskem dorzalnem rogu in so osnova dolgoletne teorije nadzora bolečine, ki domneva, da bi izguba funkcije teh zaviralnih internevronov (dezinhibicija) povzročila povečano bolečino (Melzack in Wall, 1965). Dejansko pri glodalcih dajanje antagonistov receptorjev GABA (bikukulin) ali glicina (strihnin) v hrbtenici (Malan et al., 2002; Sivilotti in Woolf, 1994; Yaksh, 1989) povzroči vedenjsko preobčutljivost, podobno tisti, ki jo opazimo po perifernem V skladu s temi opažanji periferna poškodba vodi do zmanjšanja zaviralnih postsinaptičnih tokov v nevronih površinskih hrbtnih rogov. Čeprav Moore et al. (2002) so predlagali, da je dezinhibicija posledica smrti GABAergičnih internevronov, ki jo povzroči poškodba perifernih živcev, ta trditev je bila izpodbijana (Polgar et al., 2005). Ne glede na etiologijo posledično zmanjšana tonična inhibicija poveča depolarizacijo in vzbujanje projekcijskih nevronov. Kar zadeva centralno preobčutljivost, ki jo posreduje NMDA, dezinhibicija poveča izhod hrbtenjače kot odgovor na bolečo in nebolečo stimulacijo, kar prispeva k mehanski alodiniji (Keller et al., 2007; Torsney in MacDermott, 2006).
Po prejšnjem poročilu, da je izbris gena, ki kodira PKC? pri miših povzroči izrazito zmanjšanje mehanske preobčutljivosti, ki jo povzroča poškodba živcev (Malmberg et al., 1997), nedavne študije obravnavajo vpletenost teh nevronov v dezinhibicijski proces. Tako po blokadi glicinergične inhibicije s strihninom neškodljivo ščetkanje zadnje šape aktivira PKCa-pozitivne internevrone v lamini II (Miraucourt et al., 2007), kot tudi projekcijske nevrone v lamini I. Ker PKCa-pozitivni nevroni hrbtenjače se nahajajo le v najbolj notranjem delu lamine II (slika 1), iz tega sledi, da so ti nevroni bistveni za izražanje vztrajne bolečine, ki jo povzroča poškodba živca, in da dezinhibicijski mehanizmi vodijo do njihove hiperaktivacije.
Druge študije kažejo, da spremembe v projekcijskem nevronu same po sebi prispevajo k dezinhibicijskemu procesu. Na primer, poškodba perifernega živca močno zniža K+-Cl- so-transporter KCC2, ki je bistvenega pomena za vzdrževanje normalnih K+ in Cl- gradientov čez plazemsko membrano (Coull et al., 2003). Znižanje KCC2, ki se izraža v nevronih projekcije lamine I, povzroči premik v Cl-gradientu, tako da aktivacija receptorjev GABA-A depolarizira, namesto hiperpolarizira nevrone projekcije lamine I. To bi posledično povečalo razdražljivost in povečalo prenos bolečine. Dejansko farmakološka blokada ali znižanje KCC2, ki ga posreduje siRNA, pri podganah povzroči mehansko alodinijo. Kljub temu Zeilhofer in sodelavci predlagajo, da tudi po poškodbi ostane zadosten zaviralni ton, tako da je lahko izboljšanje spinalne GABAergične nevrotransmisije dragocen pristop za zmanjšanje preobčutljivosti na bolečino, ki jo povzroča poškodba perifernega živca (Knabl et al., 2008). Pravzaprav študije na miših kažejo, da zdravila, ki so specifično usmerjena na komplekse GABAA, ki vsebujejo ?2 in/ali ?3 podenote, zmanjšajo vnetno in nevropatsko bolečino, ne da bi povzročile sedativno-hipnotične stranske učinke, ki so običajno povezani z benzodiazepini, ki povečajo aktivnost kanalov, ki vsebujejo ?1.
Dezinhibicija se lahko pojavi tudi z modulacijo glicinergične signalizacije. V tem primeru mehanizem vključuje delovanje prostaglandinov na hrbtenjačo (Harvey et al., 2004). Natančneje, poškodba tkiva povzroči sproščanje prostaglandina PGE2 v hrbtenici, ki deluje na receptorje EP2, izražene z ekscitatornimi internevroni in projekcijskimi nevroni v površnem hrbtnem rogu. Posledična stimulacija poti cAMP-PKA fosforilira podenote GlyRa3 glicinskega receptorja, zaradi česar se nevroni ne odzivajo na zaviralne učinke glicina. V skladu s tem so miši brez gena GlyRa3 zmanjšale toplotno in mehansko preobčutljivost pri modelih poškodb tkiva.
Glialno-nevronske interakcije
Nazadnje, glialne celice, zlasti mikroglija in astrociti, prav tako prispevajo k osrednjemu procesu senzibilizacije, ki se pojavi v okolju poškodbe. V normalnih pogojih mikroglija deluje kot rezidenčni makrofagi osrednjega živčnega sistema. So homogeno razporejeni v sivi snovi hrbtenjače in domnevajo, da delujejo kot stražarji poškodb ali okužb. V nekaj urah po poškodbi perifernega živca pa se mikroglija kopiči v površinskem dorzalnem rogu znotraj končne cone poškodovanih perifernih živčnih vlaken. Microglia obdaja tudi celična telesa motonevronov ventralnih rogov, katerih periferni aksoni so hkrati poškodovani. Aktivirana mikroglija sprošča množico signalnih molekul, vključno s citokini (kot so TNF-?, interlevkin-1? in 6), ki povečajo nevronsko centralno senzibilizacijo in trajno bolečino, ki jo povzroči poškodba živcev (DeLeo et al., 2007). Dejansko lahko vbrizgavanje aktivirane možganske mikroglije v možgansko hrbtenjačo na ravni hrbtenjače reproducira vedenjske spremembe, opažene po poškodbi živca (Coull et al., 2005). Tako se zdi, da aktivacija mikroglije zadostuje za sprožitev stanja obstojne bolečine (Tsuda et al., 2003).
Ker se mikroglija aktivira po poškodbi živca, ne pa tudi po poškodbi vnetnega tkiva, sledi, da aktivacija aferentnega vlakna, ki se pojavi pri obeh poškodbah, ni kritični sprožilec za aktivacijo mikroglije. Namesto tega mora fizična poškodba perifernega aferenta povzročiti sproščanje specifičnih signalov, ki jih zazna mikroglija. Glavni med njimi je ATP, ki cilja na purinergične receptorje tipa mikroglij P2. Posebej zanimivi so podtipi receptorjev P2X4 (Tsuda et al., 2003), P2X7 (Chessell et al., 2005) in P2Y12 (Haynes et al., 2006; Kobayashi et al., 2008). Dejansko je bil ATP uporabljen za aktiviranje možganske mikroglije v zgoraj omenjenih študijah presaditve hrbtenjače (Tsuda et al., 2003). Poleg tega genetska ali farmakološka blokada delovanja purinergičnih receptorjev (Chessell et al., 2005; Tozaki-Saitoh et al., 2008; Ulmann et al., 2008) prepreči ali obrne mehansko alodinijo, ki jo povzroči poškodba živca (Honore et al., 2006, 2008, 2008). ; Kobayashi et al., 2003; Tozaki-Saitoh et al., XNUMX; Tsuda et al., XNUMX).
Coull in sodelavci so predlagali model, v katerem ATP/P2X4 posredovana aktivacija mikroglije sproži mehanizem dezinhibicije (Coull et al., 2005). Natančneje, dokazali so, da ATP-izzvana aktivacija receptorjev P2X4 povzroči sproščanje nevrotrofičnega faktorja, ki izhaja iz možganov (BDNF) iz mikroglije. BDNF pa deluje na receptorje TrkB na nevronih projekcije lamine I, da ustvari spremembo v gradientu Cl, ki bi, kot je opisano zgoraj, premaknila delovanje GABA iz hiperpolarizacije v depolarizacijo. Ali učinek, ki ga povzroča BDNF, vključuje izražanje KCC2, kot se pojavi po poškodbi živca, ni znano. Ne glede na mehanizem je neto rezultat, da bo aktivacija mikroglije senzibilizirala nevrone lamine I tako, da bo njihov odziv na monosinaptične vhode iz nociceptorjev ali posredne vhode iz A? aferentov, se poveča.
Poleg BDNF aktivirana mikroglija, tako kot periferni makrofagi, sprošča in se odziva na številne kemokine in citokine, ti pa prispevajo tudi k centralni preobčutljivosti. Na primer, pri nepoškodovani (normalni) živali se kemokin fraktalkin (CXCL1) izraža tako s primarnimi aferenti kot z nevroni hrbtenjače (Lindia et al., 2005; Verge et al., 2004; Zhuang et al., 2007). V nasprotju s tem se fraktalkinski receptor (CX3CR1) izraža na mikroglialnih celicah in je pomembno, da se po poškodbi perifernega živca poveča (Lindia et al., 2005; Zhuang et al., 2007). Ker lahko spinalna dostava fraktalkina aktivira mikroglijo, se zdi, da sproščanje fraktalkina zaradi poškodbe živcev zagotavlja še eno pot, po kateri se lahko mikroglija vključi v proces centralne senzibilizacije. Dejansko blokada CX3CR1 z nevtralizirajočim protitelesom preprečuje tako razvoj kot vzdrževanje trdovratne bolečine, ki jo povzroča poškodba (Milligan et al., 2004; Zhuang et al., 2007). Ta pot je lahko tudi del pozitivne povratne zanke, skozi katero poškodovana živčna vlakna in mikroglialne celice medsebojno delujejo na vzajemni in ponavljajoči se način, da okrepijo signale bolečine. Ta točka je poudarjena z dejstvom, da je treba fraktalkin odcepiti od površine nevrona pred signalizacijo, delovanje, ki ga izvaja proteaza, ki izvira iz mikroglije, katepsin S, katerega zaviralci zmanjšujejo alodinijo in hiperalgezijo, povzročeno s poškodbo živca (Clark et. sod., 2007). Pomembno je, da spinalno dajanje katepsina S povzroči vedenjsko preobčutljivost pri divjem tipu, ne pa pri miših z izločanjem CX3CX1, ki povezuje katepsin S s fraktalkinsko signalizacijo (Clark et al., 2007; Zhuang et al., 2007). Čeprav je treba še določiti dejavnik(i), ki sproži sproščanje katepsina S iz mikroglije,. ATP se zdi razumna možnost.
V zadnjem času je bilo več članov družine Toll podobnih receptorjev (TLRs) prav tako vpletenih v aktivacijo mikroglije po poškodbi živca. TLR so transmembranski signalni proteini, izraženi v perifernih imunskih celicah in gliji. Kot del prirojenega imunskega sistema prepoznajo molekule, ki si jih na splošno delijo patogeni. Genetska ali farmakološka inhibicija funkcije TLR2, TLR3 ali TLR4 pri miših ne povzroči le zmanjšane aktivacije mikroglije, ampak tudi zmanjša preobčutljivost, ki jo povzroči poškodba perifernega živca (Kim et al., 2007; Obata et al., 2008; Tanga et al. , 2005). Neznani so endogeni ligandi, ki aktivirajo TLR2-4 po poškodbi živca. Med kandidati so mRNA ali proteini toplotnega šoka, ki bi lahko uhajali iz poškodovanih primarnih aferentnih nevronov in se razširili v zunajcelično okolje hrbtenjače.
Prispevek astrocitov k centralni preobčutljivosti je manj jasen. Astrociti se nedvomno inducirajo v hrbtenjači po poškodbi tkiva ali živca (za pregled glej Ren in Dubner, 2008). Toda v nasprotju z mikroglijo je aktivacija astrocitov na splošno zapoznela in traja veliko dlje, do nekaj mesecev. Zanimiva možnost je, da so astrociti bolj kritični za vzdrževanje, ne pa za indukcijo centralne preobčutljivosti in vztrajne bolečine.
Nazadnje je treba omeniti, da periferna poškodba ne aktivira samo glije v hrbtenjači, ampak tudi v možganskem deblu, kjer glia prispeva k supraspinalnim olajšavnim vplivom na obdelavo bolečinskih sporočil v hrbtenjači (glej sliko 2), pojav, imenovan padajoče olajšanje (za pregled glej Ren in Dubner, 2008). Takšna olajšava je še posebej izrazita pri nastanku poškodbe in zdi se, da preprečuje povratne zaviralne kontrole, ki sočasno izhajajo iz različnih lokusov možganskega debla (Porreca et al., 2002).

Insighta dr. Alexa Jimeneza
Kot je ugotovilo Mednarodno združenje za preučevanje bolečine ali IASP, je bolečina »neprijetna čutna in čustvena izkušnja, povezana z akutno ali potencialno poškodbo tkiva ali opisana v smislu poškodbe tkiva ali obojega. Predlagane so bile številne raziskave, ki dokazujejo fiziološko osnovo bolečine, vendar nobena ni mogla vključiti vseh vidikov, povezanih z zaznavanjem bolečine. Razumevanje bolečinskih mehanizmov akutne bolečine v primerjavi s kronično bolečino je temeljnega pomena med kliničnimi ocenami, saj lahko to pomaga določiti najboljši pristop k zdravljenju bolnikov z osnovnimi zdravstvenimi težavami.
Posebnosti pri prenosu in nadzoru sporočil o bolečini
Razumevanje, kako živčni sistem kodira dražljaje, da izzove ustrezno vedenje, je temeljnega pomena za preučevanje vseh senzoričnih sistemov. V najpreprostejši obliki senzorični sistem uporablja označene črte za transduciranje dražljajev in izzove vedenja skozi strogo ločena vezja. To morda najbolje ponazarja sistem okusa, kjer zamenjava sladkega receptorja za grenkega v populaciji »aferentov sladkega okusa« ne spremeni vedenja, ki ga izzove aktivnost v tej označeni liniji; v teh pogojih grenak okus stimulira te aference, da izzovejo zaznavo sladkosti (Mueller et al., 2005).
Na poti bolečine obstajajo tudi dokazi, ki podpirajo obstoj označenih črt. Kot je bilo omenjeno zgoraj, toploto in mraz zaznavajo v veliki meri različne podskupine primarnih aferentnih vlaken. Poleg tega lahko odstranitev podskupine nociceptorjev povzroči selektivne pomanjkljivosti v vedenjskem odzivu na določen škodljiv način. Na primer, uničenje nociceptorjev, ki izražajo TRPV1, povzroči močno izgubo toplotne bolečine (vključno s toplotno hiperalgezijo), brez spremembe občutljivosti na boleče mehanske ali hladne dražljaje. Nasprotno pa izbris podskupine nociceptorjev MrgprD povzroči zelo selektiven primanjkljaj mehanske odzivnosti brez spremembe občutljivosti na toploto (Cavanaugh et al., 2009). Nadaljnji dokazi za funkcionalno segregacijo na ravni nociceptorja izhajajo iz analize dveh različnih podtipov opioidnih receptorjev (Scherrer et al., 2009). Natančneje, mu opioidni receptor (MOR) prevladuje v peptidergični populaciji, medtem ko je delta opioidni receptor (DOR) izražen v nepeptidergičnih nociceptorjih. MOR-selektivni agonisti blokirajo vročino, medtem ko selektivni agonisti DOR blokirajo mehansko bolečino, kar ponovno ponazarja funkcionalno ločitev molekularno ločenih populacij nociceptorjev.
Ta opažanja zagovarjajo vedenjsko relevantno specifičnost na ravni nociceptorja. Vendar pa je to verjetno pretirana poenostavitev iz vsaj dveh razlogov. Prvič, veliko nociceptorjev je polimodalnih in jih je zato mogoče aktivirati s toplotnimi, mehanskimi ali kemičnimi dražljaji, zaradi česar se človek sprašuje, kako ima lahko izločanje velikih kohort nociceptorjev učinke, specifične za modalnost. To dokazuje bistven prispevek hrbteničnih krogov k procesu, pri katerem so nociceptivni signali kodirani v različne modalitete bolečine. Dejansko je pomemben prihodnji cilj bolje razmejiti nevronske podtipe znotraj hrbtnega roga in karakterizirati njihove sinaptične interakcije s funkcionalno ali molekularno opredeljenimi subpopulacijami nociceptorjev. Drugič, sistem bolečine kaže ogromno sposobnost za spremembe, zlasti v okolju poškodbe, kar sproža vprašanja o tem, ali in kako lahko označen sistem črt sprejme takšno plastičnost in kako spremembe v takih mehanizmih so osnova za neprilagojene spremembe, ki povzročajo kronično bolečino. Dejansko vemo, da lahko s snovjo P-saporin posredovana delecija diskretne populacije nevronov hrbtnih rogov lamine I, ki izražajo receptor za snov P, zmanjša tako toplotno kot mehansko preobčutljivost za bolečino, ki se pojavi po poškodbi tkiva ali živca (Nichols et al. ., 1999). Takšna opažanja kažejo, da pri določanju poškodbe specifičnost označene črte ni strogo vzdrževana, saj se informacije prenašajo na višje ravni nevroksi.
Jasno je, da bodo odgovori na ta vprašanja zahtevali kombinirano uporabo anatomskih, elektrofizioloških in vedenjskih metod za preslikavo fizičnega in funkcionalnega vezja, ki je osnova zaznavanja in bolečine. Nenehna identifikacija molekul in genov, ki označujejo specifične tipe nevronskih celic (tako perifernih kot centralnih), zagotavlja bistvena orodja za gensko ali farmakološko manipulacijo teh nevronov in za povezavo njihovih dejavnosti s specifičnimi komponentami vedenja bolečine v normalnih in patofizioloških okoliščinah. S tem bi se morali približati razumevanju, kako akutna bolečina odstopa od neprilagojenih sprememb, ki povzročajo kronično bolečino, in kako je mogoče to preklop preprečiti ali obrniti.

Konoplja proti marihuani: v čem je razlika?
Ker približno polovica ameriških zveznih držav zdaj dovoljuje prodajo medicinske marihuane, nekaj pa celo dovoljuje prodajo marihuane za rekreativno uporabo, se vse več ljudi zanima za možne zdravstvene koristi te kontroverzne rastline.
Medtem ko znanost o njeni medicinski uporabi še naprej napreduje, mnogi ljudje danes razmišljajo o tem, kako bi lahko dostopali do zdravstvenih koristi rastline, ne da bi izkusili njen dobro znani neželeni psihoaktivni učinek. To je povsem mogoče pri bližnji sorodniki marihuane, konoplji, vendar je bistveno, da se zavedate razlike, da boste morda pameten potrošnik.
Ena sorta popolnoma iste rastline
V bistvu sta konoplja in marihuana popolnoma ista rastlina: Cannabis sativa. Obstajajo dokazi, da so Cannabis sativa L gojili v Aziji tisoče let nazaj zaradi vlaknin in zalog hrane. Ljudje so sčasoma spoznali, da imajo cvetoči vrhovi rastline psihoaktivne lastnosti. Sčasoma, kot so ljudje to storili s številnimi drugimi rastlinami, so kmetje konoplje začeli gojiti posebne rastline, da bi izboljšali določene lastnosti.
Danes, čeprav bi nekateri trdili, da je pravo število vrst rastlin, obstajata dve preprosti razliki,
Konopljino – Rastlina, ki se v glavnem goji zunaj Združenih držav, čeprav so jo nekatere države ZDA dovolile gojiti za študijske namene) za uporabo v oblačilih, papirju, biogorivih, bioplastiki, prehranskih dopolnilih, kozmetiki in hrani. Konoplja se goji na prostem kot velik pridelek, prisotne so tako moške kot ženske rastline, da se poveča opraševanje in izboljša proizvodnja semena. Legalno uvožena industrijska konoplja vsebuje manj kot 0.3 odstotka vsebnosti kancerogene kemikalije tetrahidrokanabinola ali THC-ja. V resnici bo zakonito uvožena konoplja običajno izločila vse izvlečke iz posušenih cvetočih vrhov rastline.
marihuana (marihuana) – Cannabis sativa, posebej gojena za povečanje vsebnosti THC-ja za uporabo v medicinske ali rekreacijske namene. Rastline marihuane se običajno gojijo v zaprtih prostorih, pod nadzorovanimi pogoji, pridelovalci pa izločijo vse moške rastline iz žetve, da preprečijo oploditev, ker gnojenje znižuje stopnjo THC v rastlini.
Zakonitost medicinske marihuane
Zdravstvena uporaba marihuane je vse večje področje polemik za raziskovalce in potrošnike. Čeprav morda ni čisto polovica ameriških zveznih držav legalizirala medicinsko uporabo te rastline, je po zvezni zakonodaji še vedno nezakonita, zato njena uporaba ostaja sporna, ne glede na dejstvo, da se zdi, da obstajajo resnične zdravstvene koristi za različne resne zdravstvene težave.
Tisti, ki želijo uporabljati marihuano za medicinsko uporabo, se morajo pred uporabo pogovoriti o njenih koristih in nevarnostih s kvalificiranim zdravstvenim delavcem. Poleg tega mnogi potrošniki, ki jih zanimajo njegove zdravstvene koristi, ne potrebujejo psihoaktivnih stranskih učinkov THC-ja ali nevarnosti pozitivnega testa na droge.
Konoplja: koristi za zdravje brez tveganj
Uvožena konoplja, ki ima zelo nizko, skoraj odsotno raven THC-ja, je lahko rešitev za potrošnike, ki iščejo zdravstvene koristi rastline minus učinke THC-ja.
Čeprav ima THC nekaj zdravstvenih koristi, konoplja vsebuje več kot 80 bioaktivnih spojin, ki bi lahko zagotovile odlično podporo pri številnih zdravstvenih težavah, kot so odziv na stres, pozitivno razpoloženje in fizično nelagodje ali bolečina. Konoplja lahko koristi tudi zdravju prebavil, pomaga ohranjati zdrav vnetni odziv po celem telesu in podpira normalno delovanje imunskega sistema.
Če razmišljate o uporabi prehranskega dopolnila, ki vključuje konopljo, potem je idealno kupiti izdelek iz zaupanja vrednega vira.
V zaključku, tako periferni kot centralni živčni sistem zaznavajo, interpretirajo in uravnavajo širok spekter toplotnih in mehanskih stimulacij ter okoljskih in endogenih kemičnih dražilnih snovi. Če so dražljaji preintenzivni, lahko povzročijo akutno bolečino, kjer je v primeru trajne ali kronične bolečine lahko močno prizadet prenos bolečine. Zgornji članek opisuje celične in molekularne mehanizme bolečine za usmerjanje pri kliničnih ocenah. Poleg tega ima lahko uporaba konoplje številne koristi za zdravje v primerjavi s kontroverznimi učinki marihuane. Informacije iz Nacionalnega centra za biotehnološke informacije (NCBI). Obseg naših informacij je omejen na kiropraktiko, pa tudi na poškodbe in stanja hrbtenice. Za razpravo o temi vas prosimo, da vprašate dr. Jimeneza ali nas kontaktirate na 915-850-0900 .
Katedra dr. Alex Jimenez
Abrahamsen B, Zhao J, Asante CO, Cendan CM, Marsh S, Martinez-Barbera JP, Nassar MA, Dickenson AH, Wood JN. Celična in molekularna osnova mehanske, hladne in vnetne bolečine. znanost. 2008;321:702–705. [PubMed]
Akopian AN, Souslova V, England S, Okuse K, Ogata N, Ure J, Smith A, Kerr BJ, McMahon SB, Boyce S, et al. Natrijev kanal SNS, odporen na tetrodotoksin, ima specializirano funkcijo pri bolečinskih poteh. Nat Neurosci. 1999; 2: 541–548. [PubMed]
Alessandri-Haber N, Dina OA, Joseph EK, Reichling D, Levine JD. Prehodni receptorski potencialni mehanizem hiperalgezije, odvisen od vaniloida 4, je vključen z usklajenim delovanjem vnetnih mediatorjev. J nevrosci. 2006; 26: 3864–3874. [PubMed]
Andersson DA, Gentry C, Moss S, Bevan S. Potencial prehodnega receptorja A1 je senzorični receptor za več produktov oksidativnega stresa. J Neurosci. 2008; 28: 2485–2494. [članek brez PMC] [PubMed]
Apkarian AV, Bushnell MC, Treede RD, Zubieta JK. Človeški možganski mehanizmi zaznavanja in regulacije bolečine v zdravju in bolezni. Eur J Bolečina. 2005;9:463–484. [PubMed]
Attal N, Bouhassira D, Gautron M, Vaillant JN, Mitry E, Lepere C, Rougier P, Guirimand F. Termalna hiperalgezija kot označevalec nevrotoksičnosti oksaliplatina: prospektivna študija kvantificirane senzorične ocene. Bolečina. 2009;144:245–252. [PubMed]
Atzeni F, Turiel M, Capsoni F, Doria A, Meroni P, Sarzi-Puttini P. Avtoimunost in sredstva proti TNF-alfa. Ann NY Acad Sci. 2005;1051:559–569. [PubMed]
Bandell M, Story GM, Hwang SW, Viswanath V, Eid SR, Petrus MJ, Earley TJ, Patapoutian A. Škodljivi hladni ionski kanal TRPA1 aktivirajo ostre spojine in bradikinin. Nevron. 2004;41:849–857. [PubMed]
Basbaum AI, Jessell T. Percepcija bolečine. V: Kandel ER, Schwartz J, Jessell T, uredniki. Načela nevroznanosti. New York: Appleton in Lange; 2000. str. 472–491.
Bautista DM, Jordt SE, Nikai T, Tsuruda PR, Read AJ, Poblete J, Yamoah EN, Basbaum AI, Julius D. TRPA1 posreduje pri vnetnih učinkih okoljskih dražilnih učinkovin in proalgetikov. Celica. 2006;124:1269–1282. [PubMed]
Bautista DM, Siemens J, Glazer JM, Tsuruda PR, Basbaum AI, Stucky CL, Jordt SE, Julius D. Mentolni receptor TRPM8 je glavni detektor okoljskega mraza. Narava. 2007;448:204–208. [PubMed]
Bautista DM, Sigal YM, Milstein AD, Garrison JL, Zorn JA, Tsuruda PR, Nicoll RA, Julius D. Ostra sredstva iz sečuanske paprike vzbujajo senzorične nevrone z zaviranjem dvopornih kalijevih kanalov. Nat Neurosci. 2008;11:772–779. [članek brez PMC] [PubMed]
Bessac BF, Jordt SE. Dih jemajoči kanali TRP: TRPA1 in TRPV1 pri kemosenziranju dihalnih poti in nadzoru refleksov. Fiziologija (Bethesda) 2008;23:360–370. [članek brez PMC] [PubMed]
Bhattacharya MR, Bautista DM, Wu K, Haeberle H, Lumpkin EA, Julius D. Radialni razteg razkriva različne populacije mehanosenzitivnih somatosenzoričnih nevronov sesalcev. Proc Natl Acad Sci US A. 2008;105:20015–20020. [članek brez PMC] [PubMed]
Brown DA, Passmore GM. Nevralni kanali KCNQ (Kv7). Br J Pharmacol. 2009;156:1185–1195. [članek brez PMC] [PubMed]
Bryant BP, Mezine I. Alkilamidi, ki povzročajo mravljinčenje parestezije, aktivirajo taktilne in toplotne trigeminalne nevrone. Brain Res. 1999;842:452–460. [PubMed]
Caceres AI, Brackmann M, Elia MD, Bessac BF, del Camino D, D'Amours M, Witek JS, Fanger CM, Chong JA, Hayward NJ, et al. Senzorični nevronski ionski kanal, bistven za vnetje dihalnih poti in hiperreaktivnost pri astmi. Proc Natl Acad Sci US A. 2009; 106:9099–9104. [članek brez PMC] [PubMed]
Campbell JN, Raja SN, Meyer RA, Mackinnon SE. Mielinizirani aferenti signalizirajo hiperalgezijo, povezano s poškodbo živca. Bolečina. 1988; 32: 89–94. [PubMed]
Cao YQ. Napetostno odvisni kalcijevi kanali in bolečina. Bolečina. 2006;126:5–9. [PubMed]
Caterina MJ, Leffler A, Malmberg AB, Martin WJ, Trafton J, Petersen-Zeitz KR, Koltzenburg M, Basbaum AI, Julius D. Oslabljena nocicepcija in občutek bolečine pri miših brez receptorja za kapsaicin. znanost. 2000;288:306–313. [PubMed]
Caterina MJ, Rosen TA, Tominaga M, Brake AJ, Julius D. Homolog za kapsaicin-receptor z visokim pragom za škodljivo vročino. Narava. 1999;398:436–441. [PubMed]
Caterina MJ, Schumacher MA, Tominaga M, Rosen TA, Levine JD, Julius D. Receptor kapsaicina: toplotno aktiviran ionski kanal v poti bolečine. Narava. 1997;389:816–824. [PubMed]
Cavanaugh DJ, Lee H, Lo L, Shields SD, Zylka MJ, Basbaum AI, Anderson DJ. Različne podskupine nemieliniziranih primarnih senzoričnih vlaken posredujejo vedenjske odzive na škodljive toplotne in mehanske dražljaje. Proc Natl Acad Sci US A. 2009; 106:9075–9080. [članek brez PMC] [PubMed]
Cesare P, McNaughton P. Nov toplotno aktiviran tok v nociceptivnih nevronih in njegova senzibilizacija z bradikininom. Proc Natl Acad Sci US A. 1996; 93:15435–15439. [članek brez PMC] [PubMed]
Chalfie M. Nevrosenzorična mehanotransdukcija. Nat Rev Mol Cell Biol. 2009;10:44–52. [PubMed]
Chao MV. Nevrotrofini in njihovi receptorji: konvergenčna točka za številne signalne poti. Nat Rev Neurosci. 2003;4:299–309. [PubMed]
Chen L, Huang LY. Protein kinaza C zmanjša Mg2+ blok kanalov NMDA-receptorjev kot mehanizem modulacije. Narava. 1992;356:521–523. [PubMed]
Chen X, Alessandri-Haber N, Levine JD. Izrazito oslabitev senzibilizacije C-vlaken, ki jo povzroča vnetni mediator, za mehanske in hipotonične dražljaje pri miših TRPV4-/-. Mol bolečina. 2007; 3:31. [članek brez PMC] [PubMed]
Chessell IP, Hatcher JP, Bountra C, Michel AD, Hughes JP, Green P, Egerton J, Murfin M, Richardson J, Peck WL, et al. Motnja purinoceptorskega gena P2X7 odpravi kronično vnetno in nevropatsko bolečino. Bolečina. 2005;114:386–396. [PubMed]
Cho H, Koo JY, Kim S, Park SP, Yang Y, Oh U. Nov mehanosenzitivni kanal, identificiran v senzoričnih nevronih. Eur J Neurosci. 2006; 23: 2543–2550. [PubMed]
Cho H, Shin J, Shin CY, Lee SY, Oh U. Mehanosenzitivni ionski kanali v kultiviranih senzoričnih nevronih novorojenih podgan. J nevrosci. 2002; 22: 1238–1247. [PubMed]
Chuang HH, Prescott ED, Kong H, Shields S, Jordt SE, Basbaum AI, Chao MV, Julius D. Bradikinin in živčni rastni faktor sproščajo receptor kapsaicina iz PtdIns(4,5)P2-posredovane inhibicije. Narava. 2001;411:957–962. [PubMed]
Chung MK, Lee H, Caterina MJ. Tople temperature aktivirajo TRPV4 v mišjih 308 keratinocitih. J Biol Chem. 2003; 278: 32037–32046. [PubMed]
Clark AK, Yip PK, Grist J, Gentry C, Staniland AA, Marchand F, Dehvari M, Wotherspoon G, Winter J, Ullah J, et al. Inhibicija spinalnega mikroglialnega katepsina S za odpravo nevropatske bolečine. Proc Natl Acad Sci US A. 2007; 104:10655–10660. [članek brez PMC] [PubMed]
Colburn RW, Lubin ML, Stone DJ, Jr, Wang Y, Lawrence D, D'Andrea MR, Brandt MR, Liu Y, Flores CM, Qin N. Oslabljena hladna občutljivost pri miših TRPM8 null. Nevron. 2007;54:379–386. [PubMed]
Coull JA, Beggs S, Boudreau D, Boivin D, Tsuda M, Inoue K, Gravel C, Salter MW, De Koninck Y. BDNF iz mikroglije povzroči premik v gradientu nevronskih anionov, ki je podlaga za nevropatsko bolečino. Narava. 2005;438:1017–1021. [PubMed]
Coull JA, Boudreau D, Bachand K, Prescott SA, Nault F, Sik A, De Koninck P, De Koninck Y. Trans-sinaptični premik v anionskem gradientu v nevronih spinalne lamine I kot mehanizem nevropatske bolečine. Narava. 2003;424:938–942. [PubMed]
Cox JJ, Reimann F, Nicholas AK, Thornton G, Roberts E, Springell K, Karbani G, Jafri H, Mannan J, Raashid Y, et al. Kanalopatija SCN9A povzroča prirojeno nezmožnost doživljanja bolečine. Narava. 2006;444:894–898. [PubMed]
Cruz-Orengo L, Dhaka A, Heuermann RJ, Young TJ, Montana MC, Cavanaugh EJ, Kim D, Story GM. Kožna nocicepcija, ki jo povzroči 15-delta PGJ2 z aktivacijo ionskega kanala TRPA1. Mol bolečina. 2008; 4:30. [članek brez PMC] [PubMed]
Davies A, Hendrich J, Van Minh AT, Wratten J, Douglas L, Dolphin AC. Funkcionalna biologija alfa(2)delta podenot napetostno odvisnih kalcijevih kanalov. Trendi Pharmacol Sci. 2007;28:220–228. [PubMed]
Davis JB, Gray J, Gunthorpe MJ, Hatcher JP, Davey PT, Overend P, Harries MH, Latcham J, Clapham C, Atkinson K, et al. Vaniloidni receptor-1 je bistven za vnetno toplotno hiperalgezijo. Narava. 2000;405:183–187. [PubMed]
DeLeo JA, Sorkin LS, Watkins LR, uredniki. Imunska in glialna regulacija bolečine. IASP; Seattle: 2007.
de Vries B, Frants RR, Ferrari MD, van den Maagdenberg AM. Molekularna genetika migrene. Hum Genet. 2009;126:115–132. [PubMed]
Dhaka A, Murray AN, Mathur J, Earley TJ, Petrus MJ, Patapoutian A. TRPM8 je potreben za občutek mraza pri miših. Nevron. 2007;54:371–378. [PubMed]
Dib-Hajj SD, Yang Y, Waxman SG. Genetika in molekularna patofiziologija bolečinskih sindromov, povezanih z Na(v)1.7. Adv Genet. 2008;63:85–110. [PubMed]
Dick IE, Brochu RM, Purohit Y, Kaczorowski GJ, Martin WJ, Priest BT. Blokada natrijevih kanalov lahko prispeva k analgetični učinkovitosti antidepresivov. J Bolečina. 2007;8:315–324. [PubMed]
Dobler TM, Springauf A, Tovornik S, Weber M, Schmitt A, Sedlmeier R, Wischmeyer E, Doring F. K+ kanali TRESK z dvema porama tvorijo pomembno komponento ozadja kalijevih tokov v mišjih DRG nevronih. J Physiol 2007 [članek brez PMC] [PubMed]
Dong X, Han S, Zylka MJ, Simon MI, Anderson DJ. Raznolika družina GPCR, izraženih v posebnih podskupinah nociceptivnih senzoričnih nevronov. Celica. 2001;106:619–632. [PubMed]
Drdla R, Sandkuhler J. Dolgotrajno potenciranje na sinapsah C-vlaken z nizko stopnjo presinaptične aktivnosti in vivo. Mol bolečina. 2008; 4:18. [članek brez PMC] [PubMed]
Drew LJ, Rohrer DK, Price MP, Blaver KE, Cockayne DA, Cesare P, Wood JN. Kislinsko zaznavna ionska kanala ASIC2 in ASIC3 ne prispevata k mehansko aktiviranim tokovom v senzoričnih nevronih sesalcev. J Physiol. 2004;556:691–710. [članek brez PMC] [PubMed]
Drew LJ, Wood JN, Cesare P. Različne mehanosenzitivne lastnosti senzoričnih nevronov, občutljivih in neobčutljivih na kapsaicin. J Neurosci. 2002; 22: RC228. [PubMed]
Estacion M, Dib-Hajj SD, Benke PJ, Te Morsche RH, Eastman EM, Macala LJ, Drenth JP, Waxman SG. Mutacije za pridobivanje funkcije NaV1.7 kot kontinuum: A1632E prikazuje fiziološke spremembe, povezane z eritromelalgijo in mutacijami motenj paroksizmalne ekstremne bolečine, ter povzroča simptome obeh motenj. J nevrosci. 2008; 28: 11079–11088. [PubMed]
Fertleman CR, Baker MD, Parker KA, Moffatt S, Elmslie FV, Abrahamsen B, Ostman J, Klugbauer N, Wood JN, Gardiner RM, et al. Mutacije SCN9A pri paroksizmalni motnji ekstremne bolečine: alelne variante so osnova za različne okvare kanalov in fenotipe. Nevron. 2006;52:767–774. [PubMed]
Gevaert T, Vriens J, Segal A, Everaerts W, Roskams T, Talavera K, Owsianik G, Liedtke W, Daelemans D, Dewachter I, et al. Izbris prehodnega receptorskega potencialnega kationskega kanala TRPV4 poslabša praznjenje mišjega mehurja. J Clin Invest. 2007; 117: 3453–3462. [članek brez PMC] [PubMed]
Grant AD, Cottrell GS, Amadesi S, Trevisani M, Nicoletti P, Materazzi S, Altier C, Cenac N, Zamponi GW, Bautista-Cruz F, et al. Receptor 2, aktiviran s proteazo, senzibilizira prehodni receptorski potencial vaniloid 4 ionski kanal, da povzroči mehansko hiperalgezijo pri miših. J Physiol. 2007;578:715–733. [članek brez PMC] [PubMed]
Guler AD, Lee H, Iida T, Shimizu I, Tominaga M, Caterina M. Aktivacija ionskega kanala zaradi toplote, TRPV4. J nevrosci. 2002; 22: 6408–6414. [PubMed]
Harvey RJ, Depner UB, Wassle H, Ahmadi S, Heindl C, Reinold H, Smart TG, Harvey K, Schutz B, Abo-Salem OM, et al. GlyR alpha3: bistvena tarča za vnetno bolečino, posredovano s PGE2, v hrbtenici. znanost. 2004;304:884–887. [PubMed]
Haynes SE, Hollopeter G, Yang G, Kurpius D, Dailey ME, Gan WB, Julius D. Receptor P2Y12 uravnava mikroglialno aktivacijo z zunajceličnimi nukleotidi. Nat Neurosci. 2006;9:1512–1519. [PubMed]
Hensel H, Zotterman Y. Učinek mentola na termoreceptorje. Acta Physiol Scand. 1951; 24: 27–34. [PubMed]
Hefti FF, Rosenthal A, Walicke PA, Wyatt S, Vergara G, Shelton DL, Davies AM. Nov razred zdravil proti bolečinam, ki temelji na antagonizmu NGF. Trendi Pharmacol Sci. 2006; 27: 85–91. [PubMed]
Hensel H, Zotterman Y. Učinek mentola na termoreceptorje. Acta Physiol Scand. 1951; 24: 27–34. [PubMed]
Hill K, Schaefer M. TRPA1 je različno moduliran z amfipatskimi molekulami trinitrofenol in klorpromazin. J Biol Chem. 2007;282:7145–7153. [PubMed]
Hinman A, Chuang HH, Bautista DM, Julius D. Aktivacija kanala TRP z reverzibilno kovalentno modifikacijo. Proc Natl Acad Sci US A. 2006;103:19564–19568. [članek brez PMC] [PubMed]
Honore P, Chandran P, Hernandez G, Gauvin DM, Mikusa JP, Zhong C, Joshi SK, Ghilardi JR, Sevcik MA, Fryer RM, et al. Ponavljajoče odmerjanje ABT-102, močnega in selektivnega antagonista TRPV1, poveča analgetično aktivnost, posredovano s TRPV1, pri glodalcih, vendar oslabi hipertermijo, ki jo povzroča antagonist. Bolečina. 2009;142:27–35. [PubMed]
Honore P, Donnelly-Roberts D, Namovic MT, Hsieh G, Zhu CZ, Mikusa JP, Hernandez G, Zhong C, Gauvin DM, Chandran P, et al. A-740003 [N-(1-{[(cianoimino)(5-kinolinilamino)metil]amino}-2,2-dimetilpropil)-2-(3,4-dimetoksifenil)acetamid], nov in selektiven antagonist receptorjev P2X7 , odvisno od odmerka zmanjša nevropatsko bolečino pri podganah. J Pharmacol Exp Ther. 2006;319:1376–1385. [PubMed]
Hu J, Lewin GR. Mehanosenzitivni tokovi v nevritih kultiviranih mišjih senzoričnih nevronov. J Physiol. 2006;577:815–828. [članek brez PMC] [PubMed]
Immke DC, McCleskey EW. Laktat izboljša kislinski zaznavni Na+ kanal na nevronih, ki zaznavajo ishemijo. Nat Neurosci. 2001;4:869–870. [PubMed]
Immke DC, McCleskey EW. Protoni odpirajo ionske kanale, ki zaznavajo kisline, tako da katalizirajo lajšanje blokade Ca2+. Nevron. 2003;37:75–84. [PubMed]
Ji RR, Samad TA, Jin SX, Schmoll R, Woolf CJ. Aktivacija p38 MAPK z NGF v primarnih senzoričnih nevronih po vnetju poveča nivoje TRPV1 in vzdržuje toplotno hiperalgezijo. Nevron. 2002;36:57–68. [PubMed]
Jordt SE, Bautista DM, Chuang HH, McKemy DD, Zygmunt PM, Hogestatt ED, Meng ID, Julius D. Gorčična olja in kanabinoidi vzbujajo senzorična živčna vlakna preko TRP kanala ANKTM1. Narava. 2004;427:260–265. Epub 2004, januar 2007. [PubMed]
Julius D, Basbaum AI. Molekularni mehanizmi nocicepcije. Narava. 2001;413:203–210. [PubMed]
Karashima Y, Damann N, Prenen J, Talavera K, Segal A, Voets T, Nilius B. Bimodalno delovanje mentola na prehodni receptorski potencialni kanal TRPA1. J nevrosci. 2007; 27: 9874–9884. [PubMed]
Karashima Y, Talavera K, Everaerts W, Janssens A, Kwan KY, Vennekens R, Nilius B, Voets T. TRPA1 deluje kot senzor mraza in vitro in in vivo. Proc Natl Acad Sci US A. 2009; 106:1273–1278. [članek brez PMC] [PubMed]
Kawasaki Y, Kohno T, Zhuang ZY, Brenner GJ, Wang H, Van Der Meer C, Befort K, Woolf CJ, Ji RR. Ionotropni in metabotropni receptorji, protein kinaza A, protein kinaza C in Src prispevajo k aktivaciji ERK, ki jo povzroča C-vlakna, in fosforilaciji proteina, ki veže element na cAMP, v nevronih hrbtnega roga, kar vodi do centralne senzibilizacije. J nevrosci. 2004; 24: 8310–8321. [PubMed]
Keller AF, Beggs S, Salter MW, De Koninck Y. Transformacija izhoda nevronov spinalne lamine I po poškodbi živca in stimulaciji mikroglije, ki je osnova nevropatske bolečine. Mol bolečina. 2007; 3:27. [članek brez PMC] [PubMed]
Kim D, Kim MA, Cho IH, Kim MS, Lee S, Jo EK, Choi SY, Park K, Kim JS, Akira S, et al. Kritična vloga cestninskega receptorja 2 pri aktivaciji glialnih celic hrbtenjače, ki jo povzroča poškodba živca, in preobčutljivosti na bolečino. J Biol Chem. 2007;282:14975–14983. [PubMed]
Kindt KS, Viswanath V, Macpherson L, Quast K, Hu H, Patapoutian A, Schafer WR. Caenorhabditis elegans TRPA-1 deluje pri mehanosenziranju. Nat Neurosci. 2007;10:568–577. [PubMed]
Kirschstein T, Busselberg D, Treede RD. Koekspresija notranjih tokov, ki jih povzroča toplota in kapsaicin, v akutno disociiranih ganglijskih nevronih hrbtne korenine podgan. Neurosci Lett. 1997;231:33–36. [PubMed]
Knabl J, Witschi R, Hosl K, Reinold H, Zeilhofer UB, Ahmadi S, Brockhaus J, Sergejeva M, Hess A, Brune K, et al. Preobrat patološke bolečine s specifičnimi podtipi receptorjev za GABAA hrbtenice. Narava. 2008;451:330–334. [PubMed]
Kobayashi K, Yamanaka H, Fukuoka T, Dai Y, Obata K, Noguchi K. Upregulacija receptorjev P2Y12 v aktivirani mikrogliji je prehod signalizacije p38 in nevropatske bolečine. J nevrosci. 2008; 28: 2892–2902. [PubMed]
Kwan KY, Allchorne AJ, Vollrath MA, Christensen AP, Zhang DS, Woolf CJ, Corey DP. TRPA1 prispeva k hladni, mehanski in kemični nocicepciji, vendar ni bistven za transdukcijo lasnih celic. Nevron. 2006;50:277–289. [PubMed]
Kwan KY, Glazer JM, Corey DP, Rice FL, Stucky CL. TRPA1 modulira mehanotransdukcijo v kožnih senzoričnih nevronih. J nevrosci. 2009; 29: 4808–4819. [članek brez PMC] [PubMed]
Latremoliere A, Woolf CJ. Centralna preobčutljivost: generator preobčutljivosti za bolečino zaradi centralne nevronske plastičnosti. J Bolečina. 2009;10:895–926. [članek brez PMC] [PubMed]
Lawson JJ, McIlwrath SL, Woodbury CJ, Davis BM, Koerber HR. TRPV1 je za razliko od TRPV2 omejen na podskupino mehansko neobčutljivih kožnih nociceptorjev, ki se odzivajo na toploto. J Bolečina. 2008;9:298–308. [članek brez PMC] [PubMed]
Leffler A, Linte RM, Nau C, Reeh P, Babes A. Visokopražni toplotno aktiviran kanal v kultiviranih nevronih dorzalnih korenin ganglijskih celic podgan je podoben TRPV2 in je blokiran z gadolinijem. Eur J Neurosci. 2007;26:12–22. [PubMed]
Liedtke W, Choe Y, Marti-Renom MA, Bell AM, Denis CS, Sali A, Hudspeth AJ, Friedman JM, Heller S. Osmotsko aktiviran kanal, povezan z vaniloidnim receptorjem (VR-OAC), kandidat za osmoreceptor vretenčarjev. Celica. 2000;103:525–535. [članek brez PMC] [PubMed]
Liedtke W, Friedman JM. Nenormalna osmotska regulacija pri trpv4-/-miških. Proc Natl Acad Sci US A. 2003; 100:13698–13703. [članek brez PMC] [PubMed]
Lin YW, Cheng CM, Leduc PR, Chen CC. Razumevanje mehanotransdukcije senzoričnih živcev z lokalizirano kontrolo elastomernega matriksa. PLoS One. 2009;4:e4293. [članek brez PMC] [PubMed]
Lindia JA, McGowan E, Jochnowitz N, Abbadie C. Indukcija ekspresije CX3CL1 v astrocitih in CX3CR1 v mikrogliji v hrbtenjači pri podganskem modelu nevropatske bolečine. J Bolečina. 2005;6:434–438. [PubMed]
Liu XJ, Gingrich JR, Vargas-Caballero M, Dong YN, Sengar A, Beggs S, Wang SH, Ding HK, Frankland PW, Salter MW. Zdravljenje vnetne in nevropatske bolečine z odvajanjem Src od kompleksa receptorjev NMDA. Nat Med. 2008;14:1325–1332. [članek brez PMC] [PubMed]
Lumpkin EA, Caterina MJ. Mehanizmi senzorične transdukcije v koži. Narava. 2007;445:858–865. [PubMed]
Luo ZD, Chaplan SR, Higuera ES, Sorkin LS, Stauderman KA, Williams ME, Yaksh TL. Povečanje regulacije podenote kalcijevega kanala dorzalne korenine (alfa) 2 (delta) in njena korelacija z alodinijo pri podganah, poškodovanih s hrbteničnimi živci. J nevrosci. 2001;21:1868–1875. [PubMed]
Macpherson LJ, Dubin AE, Evans MJ, Marr F, Schultz PG, Cravatt BF, Patapoutian A. Škodljive spojine aktivirajo ionske kanale TRPA1 s kovalentno modifikacijo cisteinov. Narava. 2007;445:541–545. [PubMed]
Madrid R, de la Pena E, Donovan-Rodriguez T, Belmonte C, Viana F. Spremenljiv prag trigeminalnih hladno termosenzitivnih nevronov je določen z ravnotežjem med kalijevimi kanali TRPM8 in Kv1. J nevrosci. 2009; 29: 3120–3131. [PubMed]
Malan TP, Mata HP, Porreca F. Farmakologija receptorjev GABA(A) in GABA(B) v hrbtenici v modelu nevropatske bolečine pri podganah. Anesteziologija. 2002;96:1161–1167. [PubMed]
Malmberg AB, Chen C, Tonegawa S, Basbaum AI. Ohranjena akutna bolečina in zmanjšana nevropatska bolečina pri miših brez PKCgamma. znanost. 1997;278:279–283. [PubMed]
Mandadi S, Sokabe T, Shibasaki K, Katanosaka K, Mizuno A, Moqrich A, Patapoutian A, Fukumi-Tominaga T, Mizumura K, Tominaga M. TRPV3 v keratinocitih prenaša informacije o temperaturi senzornim nevronom 2009 [članek brez PMC] [PubMed]
Materazzi S, Nassini R, Andre E, Campi B, Amadesi S, Trevisani M, Bunnett NW, Patacchini R, Geppetti P. Cox-odvisni presnovki maščobnih kislin povzročajo bolečino z aktivacijo dražilnega receptorja TRPA1. Proc Natl Acad Sci US A. 2008; 105:12045–12050. [članek brez PMC] [PubMed]
Matta JA, Cornett PM, Miyares RL, Abe K, Sahibzada N, Ahern GP. Splošni anestetiki aktivirajo nociceptivni ionski kanal za povečanje bolečine in vnetja. Proc Natl Acad Sci US A. 2008; 105:8784–8789. [članek brez PMC] [PubMed]
McKemy DD, Neuhausser WM, Julius D. Identifikacija hladnega receptorja razkrije splošno vlogo TRP kanalov pri termosenziranju. Narava. 2002;416:52–58. [PubMed]
McMahon SB, Bennett DLH, Bevan S. Vnetni mediatorji in modulatorji bolečine. V: McMahon SB, Koltzenburg M, uredniki. Wall in Melzackov učbenik bolečine. Elsevier; 2008. str. 49–72.
Melzack R, Wall PD. Mehanizmi bolečine: nova teorija. znanost. 1965; 150: 971–979. [PubMed]
Messinger RB, Naik AK, Jagodic MM, Nelson MT, Lee WY, Choe WJ, Orestes P, Latham JR, Todorovic SM, Jevtovic-Todorovic V. In vivo utišanje kalcijevih kanalov tipa Ca(V)3.2 T v senzoričnih nevronih lajša hiperalgezijo pri podganah s streptozocinom povzročeno diabetično nevropatijo. Bolečina. 2009;145:184–195. [članek brez PMC] [PubMed]
Milligan ED, Sloane EM, Watkins LR. Glija pri patološki bolečini: vloga fraktalkina. J Nevroimunol. 2008;198:113–120. [članek brez PMC] [PubMed]
Milligan ED, Zapata V, Chacur M, Schoeniger D, Biedenkapp J, O'Connor KA, Verge GM, Chapman G, Green P, Foster AC, et al. Dokazi, da lahko eksogeni in endogeni fraktalkin povzročita nociceptivno olajšanje hrbtenice pri podganah. Eur J Neurosci. 2004; 20: 2294–2302. [PubMed]
Miraucourt LS, Dallel R, Voisin DL. Inhibicijska disfunkcija glicina spremeni dotik v bolečino prek internevronov PKCgamma. PLoS One. 2007;2:e1116. [članek brez PMC] [PubMed]
Mochizuki T, Sokabe T, Araki I, Fujishita K, Shibasaki K, Uchida K, Naruse K, Koizumi S, Takeda M, Tominaga M. Kationski kanal TRPV4 posreduje pritok Ca2+, ki ga povzroča raztezanje, in sproščanje ATP v primarnih kulturah urotelijskih celic. J Biol Chem. 2009;284:21257–21264. [članek brez PMC] [PubMed]
Moore KA, Kohno T, Karchewski LA, Scholz J, Baba H, Woolf CJ. Delna poškodba perifernega živca spodbuja selektivno izgubo GABAergične inhibicije v površinskem dorzalnem rogu hrbtenjače. J nevrosci. 2002; 22: 6724–6731. [PubMed]
Mueller KL, Hoon MA, Erlenbach I, Chandrashekar J, Zuker CS, Ryba NJ. Receptorji in logika kodiranja za grenak okus. Narava. 2005;434:225–229. [PubMed]
Muraki K, Iwata Y, Katanosaka Y, Ito T, Ohya S, Shigekawa M, Imaizumi Y. TRPV2 je sestavni del osmotsko občutljivih kationskih kanalov v mišjih aortnih miocitih. Circ Res. 2003;93:829–838. [PubMed]
Nagata K, Duggan A, Kumar G, Garcia-Anoveros J. Lastnosti nociceptorja in pretvornika lasnih celic TRPA1, kanala za bolečino in sluh. J Neurosci. 2005; 25: 4052–4061. [PubMed]
Nagy I, Rang H. Škodljiva toplota aktivira vse nevrone, ki so občutljivi na kapsaicin, in tudi podpopulacijo nevronov dorzalnih korenin hrbtne korenine, neobčutljivih na kapsaicin. nevroznanost. 1999;88:995–997. [PubMed]
Nassar MA, Levato A, Stirling LC, Wood JN. Nevropatska bolečina se običajno razvije pri miših, ki nimajo Na(v)1.7 in Na(v)1.8. Mol bolečina. 2005; 1:24. [članek brez PMC] [PubMed]
Nassar MA, Stirling LC, Forlani G, Baker MD, Matthews EA, Dickenson AH, Wood JN. Izbris gena, specifičen za nociceptor, razkriva pomembno vlogo Nav1.7 (PN1) pri akutni in vnetni bolečini. Proc Natl Acad Sci US A. 2004; 101:12706–12711. [članek brez PMC] [PubMed]
Neumann S, Braz JM, Skinner K, Llewellyn-Smith IJ, Basbaum AI. Neškodljiv, neškodljiv vnos aktivira internevrone PKCgamma hrbtnega dorzalnega roga preko mieliniziranih aferentnih vlaken. J nevrosci. 2008; 28: 7936–7944. [članek brez PMC] [PubMed]
Nichols ML, Allen BJ, Rogers SD, Ghilardi JR, Honore P, Luger NM, Finke MP, Li J, Lappi DA, Simone DA, et al. Prenos kronične nocicepcije s hrbteničnimi nevroni, ki izražajo receptor za snov P. znanost. 1999;286:1558–1561. [PubMed]
Noel J, Zimmermann K, Busserolles J, Deval E, Alloui A, Diochot S, Guy N, Borsotto M, Reeh P, Eschalier A, et al. Mehansko aktivirana K+ kanala TRAAK in TREK-1 nadzorujeta tako toplo kot hladno zaznavanje. EMBO J. 2009; 28: 1308–1318. [članek brez PMC] [PubMed]
Obata K, Katsura H, Miyoshi K, Kondo T, Yamanaka H, Kobayashi K, Dai Y, Fukuoka T, Akira S, Noguchi K. Toll-like receptor 3 prispeva k spinalni glialni aktivaciji in taktilni alodiniji po poškodbi živca. J Neurochem 2008 [PubMed]
Olausson H, Cole J, Rylander K, McGlone F, Lamarre Y, Wallin BG, Kramer H, Wessberg J, Elam M, Bushnell MC, et al. Funkcionalna vloga nemieliniziranih taktilnih aferentov v človeški dlakavi koži: simpatični odziv in zaznavna lokalizacija. Exp Brain Res. 2008;184:135–140. [PubMed]
Page AJ, Brierley SM, Martin CM, Martinez-Salgado C, Wemmie JA, Brennan TJ, Symonds E, Omari T, Lewin GR, Welsh MJ, et al. Ionski kanal ASIC1 prispeva k funkciji visceralnih, ne pa tudi kožnih mehanoreceptorjev. Gastroenterologija. 2004;127:1739–1747. [PubMed]
Peier AM, Moqrich A, Hergarden AC, Reeve AJ, Andersson DA, Story GM, Earley TJ, Dragoni I, McIntyre P, Bevan S, et al. TRP kanal, ki zazna hladne dražljaje in mentol. Celica. 2002a;108:705–715. [PubMed]
Peier AM, Reeve AJ, Andersson DA, Moqrich A, Earley TJ, Hergarden AC, Story GM, Colley S, Hogenesch JB, McIntyre P, et al. Toplotno občutljiv kanal TRP, izražen v keratinocitih. znanost. 2002b;296:2046–2049. [PubMed]
Perl ER. Ideje o bolečini, zgodovinski pogled. Nat Rev Neurosci. 2007;8:71–80. [PubMed]
Petrus M, Peier AM, Bandell M, Hwang SW, Huynh T, Olney N, Jegla T, Patapoutian A. Vloga TRPA1 pri mehanski hiperalgeziji se razkrije s farmakološko inhibicijo. Mol bolečina. 2007; 3:40. [članek brez PMC] [PubMed]
Polgar E, Hughes DI, Arham AZ, Todd AJ. Izguba nevronov iz lamin I-III hrbtnega dorzalnega roga ni potrebna za razvoj taktilne alodinije v modelu nevropatske bolečine s poškodbo živca. J nevrosci. 2005; 25: 6658–6666. [PubMed]
Porreca F, Ossipov MH, Gebhart GF. Kronična bolečina in medularno padajoče olajšanje. Trendi nevrosci. 2002;25:319–325. [PubMed]
Price MP, Lewin GR, McIlwrath SL, Cheng C, Xie J, Heppenstall PA, Stucky CL, Mannsfeldt AG, Brennan TJ, Drummond HA, et al. Natrijev kanal BNC1 pri sesalcih je potreben za normalen občutek dotika. Narava. 2000;407:1007–1011. [PubMed]
Price MP, McIlwrath SL, Xie J, Cheng C, Qiao J, Tarr DE, Sluka KA, Brennan TJ, Lewin GR, Welsh MJ. Kationski kanal DRASIC prispeva k odkrivanju kožnih dotikov in kislinskih dražljajev pri miših. Nevron. 2001;32:1071–1083. [PubMed]
Rau KK, Jiang N, Johnson RD, Cooper BY. Preobčutljivost na toploto v kožnih in mišičnih nociceptorjih, ki izražajo različne kombinacije proteina TRPV1 in TRPV2. J Nevrofiziol. 2007;97:2651–2662. [PubMed]
Rauck RL, Wallace MS, Burton AW, Kapural L, North JM. Intratekalni zikonotid za nevropatsko bolečino: pregled. Praksa proti bolečinam. 2009;9:327–337. [PubMed]
Reid G, Flonta ML. fiziologija. Hladni tok v termoreceptivnih nevronih. Narava. 2001;413:480. [PubMed]
Ren K, Dubner R. Preslušavanje nevrona in glije postane resno: vloga pri preobčutljivosti za bolečino. Curr Opin Anaesthesiol. 2008; 21: 570–579. [članek brez PMC] [PubMed]
Ritner HL, Machelska H, Stein C. Bolečina in analgezija imunskega sistema. V: Basbaum AI, Bushnell M, uredniki. Znanost o bolečini. 2009. str. 407–427.
Roza C, Puel JL, Kress M, Baron A, Diochot S, Lazdunski M, Waldmann R. Izpad kanala ASIC2 pri miših ne poslabša kožne mehanosenzacije, visceralne mehanonocicepcije in sluha. J Physiol. 2004;558:659–669. [članek brez PMC] [PubMed]
Scherrer G, Imamachi N, Cao YQ, Contet C, Mennicken F, O'Donnell D, Kieffer BL, Basbaum AI. Disociacija mehanizmov opioidnih receptorjev, ki nadzorujejo mehansko in toplotno bolečino. Celica. 2009;137:1148–1159. [članek brez PMC] [PubMed]
Schmidt R, Schmelz M, Forster C, Ringkamp M, Torebjork E, Handwerker H. Novi razredi odzivnih in neodzivnih C nociceptorjev v človeški koži. J Neurosci. 1995; 15: 333–341. [PubMed]
Sivilotti L, Woolf CJ. Prispevek GABAA in glicinskih receptorjev k centralni senzibilizaciji: dezinhibicija in alodinija, ki jo povzroča dotik v hrbtenjači. J Nevrofiziol. 1994;72:169–179. [PubMed]
Snider WD, McMahon SB. Boj proti bolečini pri viru: nove ideje o nociceptorjih. Nevron. 1998; 20: 629–632. [PubMed]
Story GM, Peier AM, Reeve AJ, Eid SR, Mosbacher J, Hricik TR, Earley TJ, Hergarden AC, Andersson DA, Hwang SW, et al. ANKTM1, TRP podoben kanal, izražen v nociceptivnih nevronih, se aktivira pri nizkih temperaturah. Celica. 2003;112:819–829. [PubMed]
Strotmann R, Harteneck C, Nunnenmacher K, Schultz G, Plant TD. OTRPC4, neselektivni kationski kanal, ki daje občutljivost na zunajcelično osmolarnost. Nat Cell Biol. 2000; 2: 695–702. [PubMed]
Sugai E, Morimitsu Y, Iwasaki Y, Morita A, Watanabe T, Kubota K. Ostre lastnosti spojin, povezanih s sanshool, ovrednotene s senzorskim testom in aktivacijo TRPV1 podgan. Biosci Biotechnol Biochem. 2005;69:1951–1957. [PubMed]
Suzuki M, Watanabe Y, Oyama Y, Mizuno A, Kusano E, Hirao A, Ookawara S. Lokalizacija mehansko občutljivega kanala TRPV4 v koži miši. Neurosci Lett. 2003;353:189–192. [PubMed]
Swayne LA, Bourinet E. Napetostno odvisni kalcijevi kanali pri kronični bolečini: nastajajoča vloga alternativnega spajanja. Pflugers Arch. 2008;456:459–466. [PubMed]
Takahashi A, Gotoh H. Mehanosenzitivni celocelični tokovi v kultiviranih somatosenzoričnih nevronih podgan. Brain Res. 2000;869:225–230. [PubMed]
Tanga FY, Nutile-McMenemy N, DeLeo JA. Vloga CNS-podobnega receptorja 4 pri prirojeni nevroimunosti in boleči nevropatiji. Proc Natl Acad Sci US A. 2005; 102:5856–5861. [članek brez PMC] [PubMed]
Tominaga M, Caterina MJ, Malmberg AB, Rosen TA, Gilbert H, Skinner K, Raumann BE, Basbaum AI, Julius D. Klonirani receptor kapsaicina integrira več dražljajev, ki povzročajo bolečino. Nevron. 1998; 21: 531–543. [PubMed]
Torsney C, MacDermott AB. Dezinhibicija odpre vrata za signalizacijo patološke bolečine v površinskih nevronih, ki izražajo receptor za nevrokinin 1, v hrbtenjači podgan. J nevrosci. 2006;26:1833–1843. [PubMed]
Tozaki-Saitoh H, Tsuda M, Miyata H, Ueda K, Kohsaka S, Inoue K. Receptorji P2Y12 v mikrogliji hrbtenice so potrebni za nevropatsko bolečino po poškodbi perifernega živca. J Neurosci. 2008; 28: 4949–4956. [PubMed]
Trevisani M, Siemens J, Materazzi S, Bautista DM, Nassini R, Campi B, Imamachi N, Andre E, Patacchini R, Cottrell GS, et al. 4-Hydroxynonenal, endogeni aldehid, povzroča bolečino in nevrogeno vnetje z aktivacijo dražilnega receptorja TRPA1. Proc Natl Acad Sci US A. 2007; 104:13519–13524. [članek brez PMC] [PubMed]
Tsuda M, Shigemoto-Mogami Y, Koizumi S, Mizokoshi A, Kohsaka S, Salter MW, Inoue K. Receptorji P2X4, inducirani pri taktilni alodiniji vrat mikroglije hrbtenice po poškodbi živca. Narava. 2003;424:778–783. [PubMed]
Ulmann L, Hatcher JP, Hughes JP, Chaumont S, Green PJ, Conquet F, Buell GN, Reeve AJ, Chessell IP, Rassendren F. Up-regulation of P2X4 receptors in spinal microglia po periferne živčevske poškodbe posreduje BDNF sproščanje in nevropatsko bolečino. J nevrosci. 2008; 28: 11263–11268. [PubMed]
Verge GM, Milligan ED, Maier SF, Watkins LR, Naeve GS, Foster AC. Porazdelitev fraktalkina (CX3CL1) in fraktalkinskega receptorja (CX3CR1) v hrbtenjači in ganglijih dorzalnih korenin pri bazalnih in nevropatskih bolečinah. Eur J Neurosci. 2004;20:1150–1160. [PubMed]
Viana F, de la Pena E, Belmonte C. Specifičnost hladne termotransdukcije je določena z diferencialno ekspresijo ionskih kanalov. Nat Neurosci. 2002;5:254–260. [PubMed]
Wetzel C, Hu J, Riethmacher D, Benckendorff A, Harder L, Eilers A, Moshourab R, Kozlenkov A, Labuz D, Caspani O, et al. Protein v domeni stomatina, ki je bistven za občutek dotika pri miški. Narava. 2007;445:206–209. [PubMed]
Woodbury CJ, Zwick M, Wang S, Lawson JJ, Caterina MJ, Koltzenburg M, Albers KM, Koerber HR, Davis BM. Nociceptorji brez TRPV1 in TRPV2 imajo normalne toplotne odzive. J nevrosci. 2004; 24: 6410–6415. [PubMed]
Woolf CJ. Dokazi za osrednjo komponento preobčutljivosti za bolečino po poškodbi. Narava. 1983;306:686–688. [PubMed]
Yagi J, Wenk HN, Naves LA, McCleskey EW. Trajni tokovi skozi ionske kanale ASIC3 pri zmernih spremembah pH, ki se pojavijo med miokardno ishemijo. Circ Res. 2006;99:501–509. [PubMed]
Yaksh TL. Vedenjski in avtonomni korelati taktilno izzvane alodinije, ki nastane zaradi inhibicije spinalnega glicina: učinki modulacijskih receptorskih sistemov in antagonistov ekscitatornih aminokislin. Bolečina. 1989;37:111–123. [PubMed]
Yang Y, Wang Y, Li S, Xu Z, Li H, Ma L, Fan J, Bu D, Liu B, Fan Z idr. Mutacije v SCN9A, ki kodirajo alfa podenoto natrijevega kanala, pri bolnikih s primarno eritermalgijo. J Med Genet. 2004;41:171–174. [članek brez PMC] [PubMed]
Zamponi GW, Lewis RJ, Todorović SM, Arneric SP, Snutch TP. Vloga napetostno odvisnih kalcijevih kanalov pri naraščajočih bolečinskih poteh. Brain Res Rev. 2009; 60:84–89. [članek brez PMC] [PubMed]
Zhuang ZY, Kawasaki Y, Tan PH, Wen YR, Huang J, Ji RR. Vloga poti CX3CR1/p38 MAPK v hrbtenični mikrogiji za razvoj nevropatske bolečine po cepljenju fraktakina, ki ga povzroča poškodba živca. Brain Behav Immun. 2007; 21: 642–651. [članek brez PMC] [PubMed]
Zimmermann K, Leffler A, Babes A, Cendan CM, Carr RW, Kobayashi J, Nau C, Wood JN, Reeh PW. Senzorični nevronski natrijev kanal Nav1.8 je bistven za bolečino pri nizkih temperaturah. Narava. 2007;447:855–858. [PubMed]
Zurborg S, Yurgionas B, Jira JA, Caspani O, Heppenstall PA. Neposredna aktivacija ionskega kanala TRPA1 s Ca2+ Nat Neurosci. 2007;10:277–279. [PubMed]
Dodatne teme: bolečina v hrbtu
bolečine v hrbtu je eden najpogostejših vzrokov invalidnosti in zamudnih dni na delovnem mestu po vsem svetu. Dejstvo je, da so bolečine v hrbtenici pripisane kot drugi najpogostejši razlogi za obiskovanje zdravniške službe, ki jih število bolnikov presega le okužbe zgornjih dihal. Približno 80 odstotkov prebivalstva bo vsaj enkrat v življenju doživelo bolečino v hrbtu. Hrbtenica je kompleksna struktura, sestavljena iz kosti, sklepov, vezi in mišic, med drugimi mehkimi tkivi. Zaradi tega so poškodbe in / ali oteženi pogoji, kot so Herniated diski, lahko sčasoma povzroči simptome bolečin v hrbtu. Športne poškodbe ali poškodbe avtomobilske nesreče so pogosto najpogostejši vzrok bolečine v hrbtu, vendar lahko včasih najpreprostejši premiki povzročijo boleče rezultate. Na srečo lahko alternativne možnosti zdravljenja, kot je zdravljenje z zdravljenjem s kerroprakom, pripomorejo k zmanjšanju bolečin v hrbtenici z uporabo prilagoditev hrbtenice in ročnih manipulacij, kar na koncu izboljša bolečino.

IZREDNO POMEMBNA TEMA: Obvladovanje bolečin v križu
VEČ TEME: DODATNO DODATNO: Kronična bolečina in zdravljenje
Objava odgovornosti
Tukaj navedeni podatki o "Mehanizmi akutne bolečine proti kronični bolečini" ni namenjeno nadomestitvi osebnega odnosa s kvalificiranim zdravstvenim delavcem ali zdravnikom z licenco in ni zdravniški nasvet. Spodbujamo vas, da sprejemate odločitve o zdravstvenem varstvu na podlagi svojih raziskav in partnerstva s kvalificiranim zdravstvenim delavcem.
Informacije o spletnem dnevniku in razprave o obsegu
Naš obseg informacij je omejena na kiropraktiko, mišično-skeletno, akupunktura, fizikalna zdravila, wellness, prispevanje etioloških viscerosomatske motnje znotraj kliničnih predstavitev, povezane klinične dinamike somatovisceralnih refleksov, kompleksi subluksacije, občutljiva zdravstvena vprašanja in/ali članki, teme in razprave o funkcionalni medicini.
Nudimo in predstavljamo klinično sodelovanje s strokovnjaki različnih strok. Vsak specialist je urejen s svojim strokovnim področjem delovanja in pristojnostjo licenciranja. Uporabljamo protokole funkcionalnega zdravja in dobrega počutja za zdravljenje in podporo oskrbe pri poškodbah ali motnjah mišično-skeletnega sistema.
Naši videoposnetki, objave, teme, teme in vpogledi pokrivajo klinične zadeve, vprašanja in teme, ki se nanašajo na naš klinični obseg prakse in ga neposredno ali posredno podpirajo.*
Naš urad je razumno poskušal zagotoviti podporne citate in je identificiral ustrezne raziskovalne študije, ki podpirajo naše objave. Na zahtevo zagotavljamo kopije podpornih raziskovalnih študij, ki so na voljo regulativnim odborom in javnosti.
Zavedamo se, da pokrivamo zadeve, ki zahtevajo dodatno razlago, kako lahko pomaga pri določenem načrtu oskrbe ali protokolu zdravljenja; zato za nadaljnjo razpravo o zgornji temi vas prosimo, da vprašate Dr. Alex Jimenez, DC, Ali nas kontaktirajte na 915-850-0900.
Tu smo, da pomagamo vam in vaši družini.
Blagoslovil
Dr. Alex Jimenez AD, MSACP, RN*, CCST, IFMCP*, CIFM*, ATN*
e-naslov: coach@elpasofunctionalmedicine.com
Licenco doktorja kiropraktike (DC) v Texas & New Mexico*
Licenca Texas DC # TX5807, Nova Mehika DC Licenca # NM-DC2182
Licenca diplomirane medicinske sestre (RN*) v Florida
Dovoljenje Florida RN Licenca št. RN9617241 (Kontrolna št. 3558029)
Kompakten status: Večdržavna licenca: Pooblaščeni za opravljanje dejavnosti v Države 40*
Trenutno matrikuliran: ICHS: MSN* FNP (Program družinske medicinske sestre)
Dr. Alex Jimenez DC, MSACP, RN* CIFM*, IFMCP*, ATN*, CCST
Moja digitalna vizitka




 Spet vas pozdravljamo¸
Spet vas pozdravljamo¸
